Вольтамперометрические и хроноамперометрические сенсоры. Примеры интеллектуальных электрохимических сенсоров
Цель лекции: объяснить слушателям принципы работы вольтамперометрических и хроноамперометрических электрохимических сенсоров и полярографов, дать представление о различных режимах их работы, об эффективных современных методах их применения. Привести примеры современных интеллектуальных электрохимических сенсоров, убедительно показывающие большие возможности, которые дает применение в таких сенсорах встроенных микрокомпьютеров, а также значимость и большой потенциал развития и дальнейшего совершенствования этих сенсоров.
17.1. Вольтамперометрические сенсоры
С целью повышения информативности электрохимического метода применяют вольтамперометрию – наблюдение за изменением (при изменениях состава контролируемого раствора) вольтамперной характеристики (" вольтамперограммы "), т.е. зависимости электрического тока через электрохимический элемент от приложенного напряжения.
Для записи вольтамперограммы контролируемый раствор заливают в электрохимическую ячейку с двумя или тремя электродами. Один из них ("измерительный" или "индикаторный") имеет относительно небольшие размеры. Площадь поверхности второго ("вспомогательного") намного больше, чтобы при протекании тока перепад потенциала на нем практически не изменялся. Как правило, в контролируемый раствор добавляют индифферентный электролит большой концентрации, чтобы уменьшить падение напряжения на его омическом сопротивлении. Для полной компенсации омического падения напряжения на электролите иногда применяют третий электрод ("электрод сравнения") и потенциостатирование.
В простейшем случае, прикладывая к электродам пошагово всё большее внешнее напряжение и измеряя протекающий ток, снимают "статическую" вольтамперную характеристику. Уже по ней можно судить о составе контролируемого раствора. Дело в том, что каждый вид ионов имеет свой характерный электрохимический потенциал. При постепенном повышении потенциала на измерительном электроде в электродную химическую реакцию вступают сначала ионы с наименьшим электрохимическим потенциалом. Это приводит к возрастанию тока. По набору потенциалов, при которых имеет место возрастание тока, можно судить о видах присутствующих в контролируемом растворе ионов. А по высоте пиков тока можно судить о концентрации соответствующего вида ионов в растворе. Ведь чем выше их концентрация, тем интенсивнее происходит электродная реакция, и тем больше протекающий ток.
При длительном использовании измерительного электрода в таком режиме на нем постепенно накапливаются продукты электролиза, которые начинают влиять на результаты измерений. Чтобы избавиться от этого, применяют индикаторные электроды из жидкого металла. Чаще всего это чистая ртуть или амальгама, заливаемая в стеклянный капилляр, из которого под действием силы тяжести происходит периодическое выкапывание и автоматическое обновление поверхности электрода. Такой электрод называют "ртутным" или "капельным". А разновидность вольтамперометрии с применением ртутного (капельного) электрода принято называть полярографией. В качестве вспомогательного электрода используют обычно каломельный или хлорсеребряный электроды.
Описанный метод "статической" вольтамперометрии и полярографии позволяет определять присутствие в растворе ионов в концентрациях от 10–5 моль/л и выше.
При вольтамперометрии с линейной разверткой потенциала приложенное к электродам напряжение линейно возрастает со временем от одного до другого заданного значения, и отслеживаются изменения тока. Благодаря ускорению процесса наращивания потенциала и возможности дифференцировать получаемый сигнал по времени удается повысить чувствительность метода до 10–6 моль/л.
Дальнейшим развитием метода стала так называемая " циклическая вольтамперометрия ". При этом методе приложенное к электродам напряжение сначала линейно нарастет ( рис. 17.1, а ), а после достижения максимального значения – линейно убывает до исходного значения. И в процессе изменений измеряют зависимость тока от напряжения ( рис. 17.1, б ). Относительно быстрая "треугольная" развертка потенциала на измерительном электроде позволяет изучать кинетику и механизм электродных процессов с участием интересующих пользователя ионов.
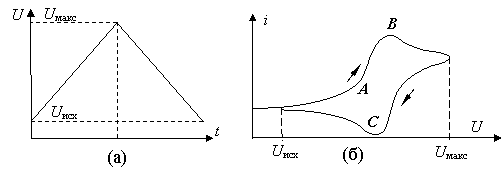
Рис. 17.1. Объяснение метода циклической вольтамперометрии: а) зависимость приложенного напряжения от времени; б) циклическая вольтамперограмма
При малом напряжении ток остается относительно небольшим. Его иногда называют "фоновым". Вблизи точки 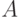 , когда приложенное напряжение становится сравнимо с контактной разностью потенциалов для исследуемых ионов, скорость электродных реакций и вместе с ней электрический ток через элемент начинают заметно возрастать. Концентрация ионов возле поверхности электрода падает. Чем выше скорость электрохимической реакции, тем быстрей эта зона обедняется, вследствие чего скорость реакции уменьшается. В некоторой точке
, когда приложенное напряжение становится сравнимо с контактной разностью потенциалов для исследуемых ионов, скорость электродных реакций и вместе с ней электрический ток через элемент начинают заметно возрастать. Концентрация ионов возле поверхности электрода падает. Чем выше скорость электрохимической реакции, тем быстрей эта зона обедняется, вследствие чего скорость реакции уменьшается. В некоторой точке 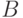 ток достигает своего максимального значения и, несмотря на дальнейший рост приложенного напряжения, начинает спадать в направлении своего стационарного значения. При уменьшении напряжения, электрический ток продолжает уменьшаться, проходя через минимум вблизи от точки
ток достигает своего максимального значения и, несмотря на дальнейший рост приложенного напряжения, начинает спадать в направлении своего стационарного значения. При уменьшении напряжения, электрический ток продолжает уменьшаться, проходя через минимум вблизи от точки 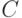 .
.
Вид циклической вольтамперограммы зависит от всех особенностей происходящих в ячейке электрохимических реакций. Если электрохимические превращения возле электродов обратимы, то среднее арифметическое значение от напряжений, при которых достигаются максимум электрического тока (в точке 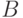 ) и минимум (в точке
) и минимум (в точке 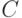 ), равняется электродному потенциалу данного элемента. Если же реакции являются частично или полностью необратимыми, то это не имеет место, а минимум тока может вообще отсутствовать. Форма циклической вольтамперограммы зависит и от скорости изменения напряжения. Все это может давать исследователю много ценной информации относительно кинетики электрохимических процессов в исследуемом растворе и о его составе.
), равняется электродному потенциалу данного элемента. Если же реакции являются частично или полностью необратимыми, то это не имеет место, а минимум тока может вообще отсутствовать. Форма циклической вольтамперограммы зависит и от скорости изменения напряжения. Все это может давать исследователю много ценной информации относительно кинетики электрохимических процессов в исследуемом растворе и о его составе.
Еще более перспективной оказалась " вольтамперометрия переменного тока ". Потенциал измерительного электрода складывается при этом методе из линейно или ступенчато нарастающего напряжения постоянного смещения и переменного измерительного напряжения малой амплитуды в несколько милливольт. При этом измеряется не весь ток через измерительный электрод, а только его переменная составляющая, синхронная с переменным напряжением. Накладываемое переменное напряжение может быть синусоидальным, может иметь форму прямоугольного меандра (тогда говорят о " квадратноволновой вольтамперометрии ") или др. Такой метод позволил повысить чувствительность обнаружения аналита почти на 2 порядка. Примерно такие же результаты дает " импульсна я вольтамперометрия ", при которой на напряжение постоянного смещения накладываются небольшие измерительные импульсы и измеряются синхронно связанные с ними импульсные приращения тока.
Почти во всех вариантах вольтамперометрии чувствительность обнаружения можно дополнительно повысить, стимулируя различными методами предварительное накопление аналита возле измерительного электрода или на нем. Чувствительность обнаружения может при этом достигать 10–9 - 10–10 моль/л.
Из множества возможных приведем лишь пару примеров применения вольтамперометрии. В работе [
[
339
]
, стр. 265] описана методика определения методом циклической вольтамперометрии концентрации ионов 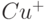 . Для этого использовались специфический комплексон таких ионов ДМФ (2, диметил-1, 10-фенантролин) и потенциостат BAS CV-1B. Чувствительность обнаружения составляла 5 нмоль/л.
. Для этого использовались специфический комплексон таких ионов ДМФ (2, диметил-1, 10-фенантролин) и потенциостат BAS CV-1B. Чувствительность обнаружения составляла 5 нмоль/л.
В работе [ [ 13 ] ] описана методика выявления таким методом присутствия в питьевой воде нитридов с чувствительностью 2 мкмоль/л и измерения их концентрации в диапазоне от 10 мкмоль/л до 1000 мкмоль/л.
17.2. Хроноамперометрические сенсоры
Еще большие информационные возможности даёт метод , который основан на анализе зависимости тока через электрохимический элемент от времени при ступенчатом, линейном или синусоидальном изменении приложенного напряжения. Используют и наложение на постоянное напряжение смещения периодических импульсов напряжения разной формы и амплитуды либо небольшого измерительного переменного напряжения. Для получения дополнительной информации применяют также такие внешние воздействия на электрохимический элемент, как изменение условий перемешивания исследуемого раствора, дозированное добавление по каплям других растворов, быстрая замена измерительного электрода на другой (из другого материала) и т.п. [ [ 89 ] , [ 243 ] , [ 339 ] ]. При использовании такого арсенала воздействий можно определять наличие и концентрацию в растворе почти всех видов ионов и многих органических молекул в широком диапазоне концентраций (от 10–10 моль/л до 1 моль/л), исследовать природу соответствующих электрохимических реакций и их подробные кинетические характеристики.
В наиболее общем виде результаты хроноамперометрических исследований представляют в виде двух взаимосвязанных графиков. Один из них – это зависимость приложенного напряжения от времени, а второй – это зависимость от времени силы тока через электрохимический элемент ( рис. 17.2) [ [ 339 ] ]. На временнoй диаграмме отмечают также моменты или периоды дополнительных внешних воздействий на исследуемый раствор. Например, на приведенной хроноамперограмме цифрой 1 отмечен момент времени, когда было прекращено перемешивание раствора и скачком увеличено приложенное напряжение. Соответствующий участок хроноамперограммы позволяет наблюдать кинетику происходящих реакций в режиме диффузии ионов к электродам.
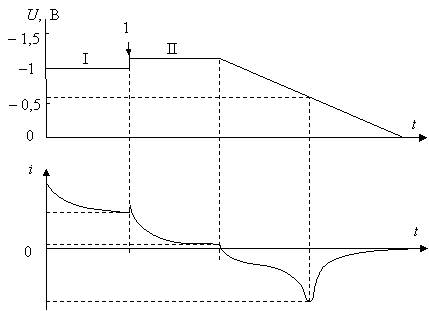
Рис. 17.2. Пример простой хроноамперограммы: І - период наблюдения с непрерывным перемешиванием раствора (2-15 мин); 1 - момент прекращения перемешивания и увеличения приложенного напряжения; ІІ - период наблюдения без перемешивания раствора
Если требуется, то вычисляют производную зависимости силы тока от времени и приводят соответствующий график. Или выполняют другие существенные преобразования получаемой информации, исходя из известной либо предполагаемой математической модели происходящих процессов. При наличии такой модели, используя результаты хроноамперометрического исследования, можно определить природу и находить кинетические характеристики происходящих в растворе химических реакций и реагирующих веществ.
В интеллектуальных сенсорах, с использованием встроенного в них микрокомпьютера, все требуемые для исследования раствора манипуляции и преобразования информации можно автоматизировать. Интеллектуальные сенсоры могут сами автоматически выполнять и уже наработанные, даже и сложные, методики (алгоритмы) исследований, и позволяют самому пользователю (без привлечения программиста) разрабатывать и запоминать новые методики.
