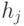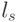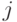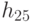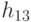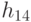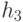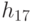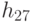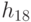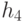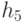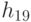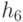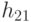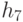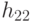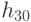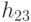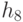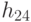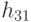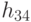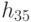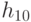Нейроподобные модели как формально-логический базис анализа живых систем
Абстрагируемся от конкретных молекулярно-биологических и физико-химических механизмов взаимного узнавания кодонов и анти-кодонов, но сохраним в многопороговой модели вариативный характер этих процедур, который не нарушает отношений вырожденности и/или комплементарности биологического кода. В частности, в любой процедуре идентификации "признак конца" должен быть инвариантен множеству идентифицируемых объектов или процессов. Этому требованию в каждом элементарном акте инструктированного синтеза биополимеров удовлетворяет константа комплементарности, которая представляет собой сумму взвешенных идентификационных активностей кодонов 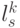 и антикодонов
и антикодонов  и в нашем случае она равна:
и в нашем случае она равна:
 |
( 8.6) |
Строгое выполнение критерия (8.6) нарушает вариативный характер процедуры взаимной идентификации фиксированного кодона 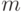 -РНК и некоторой совокупности (квази)комплементарных антикодонов
-РНК и некоторой совокупности (квази)комплементарных антикодонов  -РНК, так как, согласно экспериментальным данным (табл. 8.3 [219]), одной и той же аминокислотой можно "нагрузить" от одного до трех типов
-РНК, так как, согласно экспериментальным данным (табл. 8.3 [219]), одной и той же аминокислотой можно "нагрузить" от одного до трех типов  -РНК.
-РНК.
Такому неоднозначному соответствию в реальных комплексах "ами-ноацил -  -РНК" отвечает формальная схема взаимной идентификации
-РНК" отвечает формальная схема взаимной идентификации 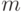 -РНК и
-РНК и  -РНК, в которой критерий (8.6) расчленен на две составляющие: дуплетную
-РНК, в которой критерий (8.6) расчленен на две составляющие: дуплетную 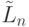 и мономерную
и мономерную  , такие, что
, такие, что 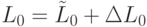 . На первом этапе трансляции взаимное узнавание кодонов и антикодонов осуществляется по суммарной взвешенной идентификационной активности левых и центральных оснований:
. На первом этапе трансляции взаимное узнавание кодонов и антикодонов осуществляется по суммарной взвешенной идентификационной активности левых и центральных оснований:  . Поэтому дуплетный "признак конца" имеет вид:
. Поэтому дуплетный "признак конца" имеет вид:
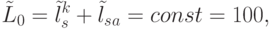 |
( 8.7) |
что гарантирует только временное спаривание кодонов и антикодонов. Это условие является необходимым и проверяется структурным методом, то есть прямой подстановкой (замещением) "нагруженных"  -РНК (см. рис. 8.2) в комплексе "
-РНК (см. рис. 8.2) в комплексе " 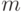 -РНК - рибосома - аминоацил -
-РНК - рибосома - аминоацил -  -РНК" (см. рис. 8.1). Отделение аминокислоты от
-РНК" (см. рис. 8.1). Отделение аминокислоты от  -РНК и включение ее в полимер синтезируемого белка требует соблюдения второго, достаточного условия:
-РНК и включение ее в полимер синтезируемого белка требует соблюдения второго, достаточного условия:
 |
( 8.8) |
Условие (8.8) проверяется параметрической вариацией взвешенной идентификационной активности только правого основания антикодона  и после того, как выполнено условие (8.7), то есть когда ком-плекс "
и после того, как выполнено условие (8.7), то есть когда ком-плекс " 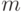 -РНК - рибосома - аминоацил -
-РНК - рибосома - аминоацил -  -РНК" структурно фиксирован. Если допустимая вариация "веса" правого основания антикодона
-РНК" структурно фиксирован. Если допустимая вариация "веса" правого основания антикодона  не приводит к выполнению условия (8.8), то происходит замеще-ние "нагруженной"
не приводит к выполнению условия (8.8), то происходит замеще-ние "нагруженной"  -РНК в комплексе и цикл 2-этапной структурно-параметрической идентификации повторяется.
-РНК в комплексе и цикл 2-этапной структурно-параметрической идентификации повторяется.
Здесь:
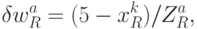 |
( 8.9) |
где  - идентификационная активность правого основания базового антикодона в "неоднозначном" подмножестве, причем соотношение (8.9) в реальных условиях можно реализовать как экспрессией, так и супрессией механизма "взвешивания" идентификационных активностей (анти)кодонов. Работу 2-этапной схемы структурно-параметрической идентификации проиллюстрируем на примере экспрессии механизмов подстановки в молекулу белка аминокислоты АЛА, которая входит в состав двух типов аминоациловых комплексов "АЛА -
- идентификационная активность правого основания базового антикодона в "неоднозначном" подмножестве, причем соотношение (8.9) в реальных условиях можно реализовать как экспрессией, так и супрессией механизма "взвешивания" идентификационных активностей (анти)кодонов. Работу 2-этапной схемы структурно-параметрической идентификации проиллюстрируем на примере экспрессии механизмов подстановки в молекулу белка аминокислоты АЛА, которая входит в состав двух типов аминоациловых комплексов "АЛА -  -РНК" и "АЛАI -
-РНК" и "АЛАI -  -РНК" [219]. Согласно экспериментальным данным, первый из этих комплексов идентифицируется кодонами ЦГГ, ЦГА, ЦГУ и его можно обозначить АЛА -
-РНК" [219]. Согласно экспериментальным данным, первый из этих комплексов идентифицируется кодонами ЦГГ, ЦГА, ЦГУ и его можно обозначить АЛА -  -РНК (ГЦЦ), а второй комплекс идентифицируется кодонами ЦГУ, ЦГЦ и его можно обозначить АЛАI -
-РНК (ГЦЦ), а второй комплекс идентифицируется кодонами ЦГУ, ЦГЦ и его можно обозначить АЛАI -  -РНК (ГЦА). Здесь в скобках указаны базовые антикодоны, основания которых (для простоты) перечислены в том же порядке, что и комплементарные им основания кодонов (см. рис. 8.1). Согласно (8.9), в формальной модели первому аминоациловому комплексу отвечают вариации
-РНК (ГЦА). Здесь в скобках указаны базовые антикодоны, основания которых (для простоты) перечислены в том же порядке, что и комплементарные им основания кодонов (см. рис. 8.1). Согласно (8.9), в формальной модели первому аминоациловому комплексу отвечают вариации  , так как в этом случае
, так как в этом случае 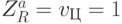 , а
, а  , а второму - вариации
, а второму - вариации  , так как в этом случае
, так как в этом случае 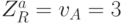 , а
, а  .
.
Пусть рибосомой инициализирован кодон ЦГЦ и первым на идентификацию поступил комплекс "АЛА -  -РНК (ГЦЦ)", вариационную базу которого образует основание Ц, а вариационное смещение "веса" идентификационной активности составляет 3 шага, которые вычисляются согласно (8.9). В таких условиях сработает критерий (8.7), что приведет к образованию временно устойчивого комплекса "ЦГЦ - рибосома - АЛА -
-РНК (ГЦЦ)", вариационную базу которого образует основание Ц, а вариационное смещение "веса" идентификационной активности составляет 3 шага, которые вычисляются согласно (8.9). В таких условиях сработает критерий (8.7), что приведет к образованию временно устойчивого комплекса "ЦГЦ - рибосома - АЛА -  -РНК (ГЦЦ)". Однако допустимая вариация "веса" базового основания антикодона не обеспечивает выполнение условия (8.8):
-РНК (ГЦЦ)". Однако допустимая вариация "веса" базового основания антикодона не обеспечивает выполнение условия (8.8):  ;
; 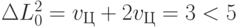 ;
; 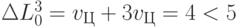 . В результате по правилам работы формальной модели аминоаци-ловый комплекс должен полностью отделиться от полисомы (ЦГЦ - рибосома). Если после этого к полисоме присоединится комплекс "АЛАI -
. В результате по правилам работы формальной модели аминоаци-ловый комплекс должен полностью отделиться от полисомы (ЦГЦ - рибосома). Если после этого к полисоме присоединится комплекс "АЛАI -  -РНК (ГЦА)", то сменится вариационная база и вариационное смещение. Это приведет к срабатыванию условия (8.8):
-РНК (ГЦА)", то сменится вариационная база и вариационное смещение. Это приведет к срабатыванию условия (8.8): 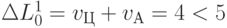 ;
; 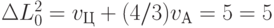 . В результате согласно принятым правилам от полисомы должна отделиться только
. В результате согласно принятым правилам от полисомы должна отделиться только  -РНК (ГЦА), а аминокислота АЛАI должна включиться в состав полимера белка.
-РНК (ГЦА), а аминокислота АЛАI должна включиться в состав полимера белка.
Из приведенных данных видно:
- В формальной модели отделение
 -РНК от полисомы происходит в любом случае, но при выполнении условия (8.8) аминокислота остается на полисоме для закрепления в структуре синтезируемого "биополимера", а при невыполнении этого условия она отходит от полисомы в составе аминоацилового комплекса.
-РНК от полисомы происходит в любом случае, но при выполнении условия (8.8) аминокислота остается на полисоме для закрепления в структуре синтезируемого "биополимера", а при невыполнении этого условия она отходит от полисомы в составе аминоацилового комплекса. - Классические (много)пороговые модели отличаются от реальных молекулярно-биологических процессов механизмами настройки: в первых - это классическая параметрическая адаптация "весового" вектора, вектора порогов и правила подстановки выходного алфавита, а во вторых - это структурно-параметрическая идентификация.
В реальных условиях вариациям "веса" идентификационной активности базового нуклеотида отвечают конформационные преобразования вторичной и/или третичной структуры аминоацилового комплекса, в котором основания кодонов расположены в пространстве антисимметрично комплементарным им основаниям антикодонов. В нашем примере кодону ЦГЦ соответствует обратный порядок перечисления частично комплементарных оснований базового антикодона, то есть АЦГ. Поэтому в модели полноценная комплементарная пара может образоваться при срабатывании условия (8.7) и только между наиболее "весомыми" центральными основаниями антикодона и базового кодона, то есть пара Г-Ц. В реальных условиях это соответствует установлению водородных связей между менее "весомыми" и антисимметрично расположенными левым основанием кодона и правым основанием антикодона, что может привести к вращению первого. В результате такого скручивания реального комплекса "аминоацил -  -РНК" происходит экспрессия "веса" антисимметричной условно комплементарной связи Ц-А до "взвешенного" значения, отвечающего полноценной комплементарной связи Ц-Г, что приводит к отрыву
-РНК" происходит экспрессия "веса" антисимметричной условно комплементарной связи Ц-А до "взвешенного" значения, отвечающего полноценной комплементарной связи Ц-Г, что приводит к отрыву  -РНК, но при выполнении условия (8.8) аминоацило-вый комплекс разрывается и аминокислота остается на полисоме.
-РНК, но при выполнении условия (8.8) аминоацило-вый комплекс разрывается и аминокислота остается на полисоме.
Действие классического супрессора [230] в конечном счете сводится к тому, что он восстанавливает способность к синтезу белка в условиях, когда произошла "бессмысленная" мутация, прерывающая синтез полимера белка. Классический супрессор изменяет активность оснований кодонов, а не механизм "взвешенного" суммирования. Это не противоречит условиям (8.7) и (8.8) правильной работы молекулярно-биологической многопороговой модели, так как в них входят компоненты сопряженных векторов: "весового" 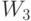 и входного
и входного  .
.
Сказанное проиллюстрируем примером восстановления в формальной модели структурных "мутаций" биологического кода, которые в реальных условиях привели к образованию amber-кодона УАГ, прерывающего синтез полимера белка. Согласно [230], супрессор Su -1 способен восстановить такую мутацию синтезом белка СЕР (кодон УЦГ); супрессор Su -2 - синтезом белка ГЛУ (кодон ГАГ); супрессор Su -3 - синтезом белка ТИР (кодон УАЦ). Отсюда, amber-кодон УАГ может быть идентифицирован антикодонами: АГЦ, ЦУЦ и АУГ. Воспроизвести механизм супрессии антикодона в формальной паре УАГ-АГЦ можно, понизив идентификационную активность центрального нуклеотида с  до
до 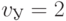 ; в формаль-
; в формаль-
ной паре УАГ-ЦУЦ - повысив идентификационную активность левого нуклеотида с 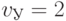 до
до  ; в формальной паре УАГ-АУГ - понизив идентификационную активность правого нуклеотида с
; в формальной паре УАГ-АУГ - понизив идентификационную активность правого нуклеотида с  до
до 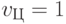 .
.
В реальных условиях аналогично работают супрессоры и для осмысленных кодонов, что приводит к "смысловому изменению" одного из оснований и, как следствие, к замещению аминокислоты в полимере белка. Такую мутацию называют условной, так как она проявляется только при наличии супрессора, а при его отсутствии синтезируется белок-предшественник.
Экспрессиям и супрессиям идентификационной активности оснований реальных (анти)кодонов отвечают конформационные преобразования, которые действуют только на одном цикле синтеза белка. В итоге можно предложить следующую схему отбора "мутаций" формального биологического кода, в которой минимизируются риски получения фатальных "мутаций". В этой схеме на 1-й фазе используются случайные или целенаправленные вариации идентификационной активности оснований (анти)кодонов, которые отвечают конформационным преобразованиям реальных молекулярно-биологических комплексов. Их последействие ограничено одним циклом синтеза биополимера, что позволяет считать такие преобразования обратимыми. На 2-й фазе наработанные позитивные и негативные изменения в инструктированном синтезе формальных "белков" закрепляются или блокируются с помощью механизмов структурно-параметрической экспрессии или супрессии, которые обеспечивают альтернативные пути синтеза и использования "биополимеров". На 3-й фа зе случайные или целенаправленные структурные "мутации" закрепляются в формальном "биологическом коде", что делается с минимально возможным риском за счет накопленного опыта в процедурах временного и условного замещения аминокислот и изменения функций полимеров формального "белка".
Транскрипция биологического кода предшествует рассмотренным выше процедурам трансляции, и с формальных позиций она представляет собой взаимно однозначное отображение множества триплетов ДНК в множество триплетов РНК  с безусловным замещением (подстановкой) основания тимина (Т) на урацил (У). Отсюда:
с безусловным замещением (подстановкой) основания тимина (Т) на урацил (У). Отсюда:
- В процессе эволюционного отбора отображения
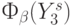 необходимо было оценить всего 15 вариантов замещения: одного, двух, трех и четырех оснований ДНК.
необходимо было оценить всего 15 вариантов замещения: одного, двух, трех и четырех оснований ДНК. - (Много)пороговая модель этапа транскрипции представляет собой максимально пороговую реализацию
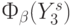 с
с  .
.
Проведенные исследования многопороговой модели биологического кода показали:
- Для формализации практически всех процедур и этапов инструктированного синтеза нативных белков достаточно одного определения идентификационной активности субклеточных структур, которая лежит в основе структурно-параметрической идентификации.
- Многообразие таблиц вырожденности биологического кода носит гиперкомбинаторный характер, и оно на 63 порядка превосходит количество вариантов синтеза ДНК, которое можно было осуществить методами и средствами самоорганизации диссипативных структур за время существования Вселенной. Мощность пространства эволюционного отбора таблиц вырожденности молекулярно-биологического кода для всей экосистемы Земли всего на три порядка превосходит аналогичную мощность для генетического кода человека.
- Многопороговая модель биологического кода применима практически ко всем этапам и процедурам инструктированного синтеза макромолекул белка.