|
Где можно посмотреть информацию о физических ограничениях на значения характеристик компьютеров |
Фуллерены, углеродные нанотрубки и прочие кластеры
Углерод - уникальный химический элемент
Атомы углерода (англ. carbon) являются химически уникальными. В чем именно заключается эта уникальность? Попробуем объяснить.
Эти атомы в основном состоянии имеют электронную конфигурацию 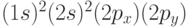 . Следовательно, в них имеются две электронные оболочки. Энергетические уровни, соответствующие атомным орбиталям (АО)
. Следовательно, в них имеются две электронные оболочки. Энергетические уровни, соответствующие атомным орбиталям (АО) 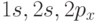 и
и 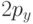 , и схема заполнения соответствующих АО электронами показаны на
рис.
5.1.а. Два электрона на внутренней электронной оболочке (
, и схема заполнения соответствующих АО электронами показаны на
рис.
5.1.а. Два электрона на внутренней электронной оболочке ( ) очень сильно связаны с ядром: энергия связи каждого из них 288 эВ. Эта электронная оболочка скрыта глубоко внутри атома. Вместе с ядром она образует химический "остов" атома, который сохраняется практически неизменным при формировании молекул.
На внешней электронной оболочке находятся 4 электрона, из них 2 спаренных – на атомных орбиталях подоболочки
) очень сильно связаны с ядром: энергия связи каждого из них 288 эВ. Эта электронная оболочка скрыта глубоко внутри атома. Вместе с ядром она образует химический "остов" атома, который сохраняется практически неизменным при формировании молекул.
На внешней электронной оболочке находятся 4 электрона, из них 2 спаренных – на атомных орбиталях подоболочки 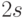 , которая полностью заполнена. Казалось бы, атомы углерода должны иметь химическую валентность 2, образуя ковалентные связи при участии лишь двух не спаренных
, которая полностью заполнена. Казалось бы, атомы углерода должны иметь химическую валентность 2, образуя ковалентные связи при участии лишь двух не спаренных 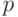 -электронов. Однако, благодаря описанной в
"Фуллерены, углеродные нанотрубки и прочие кластеры"
гибридизации АО, при относительно небольших затратах энергии в атоме углерода возможно образование гибридных
-электронов. Однако, благодаря описанной в
"Фуллерены, углеродные нанотрубки и прочие кластеры"
гибридизации АО, при относительно небольших затратах энергии в атоме углерода возможно образование гибридных  ,
, 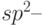 и
и 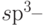 орбиталей.
орбиталей.
Энергетический уровень гибридной 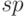 –АО (–19,6 эВ) и заполнение АО электронами при
–АО (–19,6 эВ) и заполнение АО электронами при 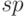 –гибридизации показаны на
рис.
5.1.б, а форма двух образованных гибридных
–гибридизации показаны на
рис.
5.1.б, а форма двух образованных гибридных 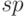 –орбиталей была показана в
"Фуллерены, углеродные нанотрубки и прочие кластеры"
(
рис.
5.6). В состоянии
–орбиталей была показана в
"Фуллерены, углеродные нанотрубки и прочие кластеры"
(
рис.
5.6). В состоянии 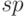 –гибридизации атом углерода становится уже 4-валентным и может образовать 4 ковалентные химические связи. Класс химических соединений, в которых атом углерода выступает в таком состоянии, называют алкинами. Типичным их представителем является ацетилен со структурной формулой
–гибридизации атом углерода становится уже 4-валентным и может образовать 4 ковалентные химические связи. Класс химических соединений, в которых атом углерода выступает в таком состоянии, называют алкинами. Типичным их представителем является ацетилен со структурной формулой  . Молекула ацетилена – линейная.
Три молекулярные
. Молекула ацетилена – линейная.
Три молекулярные 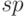 –орбитали, ориентированные под углами
–орбитали, ориентированные под углами 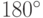 и вытянутые вдоль оси ОХ, химически связывают между собой атомы углерода и атомы углерода с атомами водорода. А ориентированные к ним перпендикулярно
и вытянутые вдоль оси ОХ, химически связывают между собой атомы углерода и атомы углерода с атомами водорода. А ориентированные к ним перпендикулярно  – и
– и 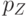 –орбитали атомов углерода, перекрываясь (подобно изображенным на
рис.
5.5), образуют соединительные молекулярные
–орбитали атомов углерода, перекрываясь (подобно изображенным на
рис.
5.5), образуют соединительные молекулярные 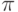 –орбитали. В результате атомы углерода в этой молекуле связаны между собой тройной химической связью: одной
–орбитали. В результате атомы углерода в этой молекуле связаны между собой тройной химической связью: одной 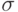 -связью и двумя
-связью и двумя 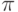 -связями.
-связями.
Энергетический уровень гибридной 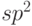 –АО (–16,8 эВ) и заполнение АО электронами при
–АО (–16,8 эВ) и заполнение АО электронами при 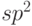 -гибридизации показаны на
рис.
5.1.в, а форма трех образованных гибридных
-гибридизации показаны на
рис.
5.1.в, а форма трех образованных гибридных 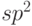 –орбиталей была показана в
"Фуллерены, углеродные нанотрубки и прочие кластеры"
(
рис.
5.7). В состоянии
–орбиталей была показана в
"Фуллерены, углеродные нанотрубки и прочие кластеры"
(
рис.
5.7). В состоянии 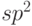 -гибридизации атом углерода тоже является 4-валентным. Класс химических соединений, в которых атом углерода выступает в таком состоянии, называют алкенами. Типичным их представителем является этилен со структурной формулой
-гибридизации атом углерода тоже является 4-валентным. Класс химических соединений, в которых атом углерода выступает в таком состоянии, называют алкенами. Типичным их представителем является этилен со структурной формулой
Молекула этилена плоская. Гибридные 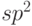 –орбитали, ориентированные под углами
–орбитали, ориентированные под углами  , образуют три
, образуют три 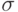 -связи атомов углерода с атомами водорода и атомов углерода между собой. Ориентированные перпендикулярно к ним
-связи атомов углерода с атомами водорода и атомов углерода между собой. Ориентированные перпендикулярно к ним 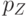 –орбитали, перекрываясь, образуют связывающую молекулярную
–орбитали, перекрываясь, образуют связывающую молекулярную 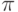 –орбиталь, которая дополнительно соединяет атомы углерода. В результате они в этой молекуле связаны двойной химической связью: одной
–орбиталь, которая дополнительно соединяет атомы углерода. В результате они в этой молекуле связаны двойной химической связью: одной 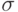 -связью и одной
-связью и одной 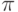 -связью.
-связью.
Энергетический уровень 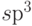 –АО (–14,1 эВ) и заполнение АО электронами при
–АО (–14,1 эВ) и заполнение АО электронами при 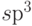 -гибридизации показаны на
рис.
5.1.г, а форма четырех образованных гибридных
-гибридизации показаны на
рис.
5.1.г, а форма четырех образованных гибридных 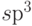 –орбиталей была показана в
"Фуллерены, углеродные нанотрубки и прочие кластеры"
(
рис.
5.8). В этом состоянии атом углерода тоже является 4-валентным. Класс химических соединений, в которых атом углерода выступает в таком состоянии, называют алканами. Типичным их представителем является этан со структурной формулой, показанной на
рис.
5.2 слева.
–орбиталей была показана в
"Фуллерены, углеродные нанотрубки и прочие кластеры"
(
рис.
5.8). В этом состоянии атом углерода тоже является 4-валентным. Класс химических соединений, в которых атом углерода выступает в таком состоянии, называют алканами. Типичным их представителем является этан со структурной формулой, показанной на
рис.
5.2 слева.
Молекула этана объемная и напоминает два соединенных вершинами тетраэдра, в основаниях которых размещены по 3 атома водорода, а в вершинах – атомы углерода. Два последние между собой и с каждым соседним атомом водорода соединены тетраэдрическими молекулярными орбиталями, ориентированными под углами 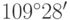 друг к другу.
друг к другу.
В 1964 г. были синтезированы молекулы  , названные кубаном, поскольку атомы углерода в них расположены в вершинах куба (
рис.
5.3 слева).
, названные кубаном, поскольку атомы углерода в них расположены в вершинах куба (
рис.
5.3 слева).
Тем самым было установлено, что атомы углерода могут входить в химические соединения также и в первом возбужденном состоянии, когда один из электронов переходит с АО 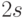 на свободную АО
на свободную АО 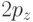 . Атом углерода в этом состоянии тоже является 4-валентным и имеет электронную конфигурацию
. Атом углерода в этом состоянии тоже является 4-валентным и имеет электронную конфигурацию 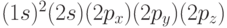 . Три атомные
. Три атомные 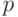 -орбитали в этом случае взаимно перпендикулярны и образуют ковалентные связи, ориентированные под углами
-орбитали в этом случае взаимно перпендикулярны и образуют ковалентные связи, ориентированные под углами  . Именно поэтому атомы углерода размещаются в вершинах куба. Ковалентные связи с атомом водорода и соответствующие молекулярные орбитали формируются из одной
. Именно поэтому атомы углерода размещаются в вершинах куба. Ковалентные связи с атомом водорода и соответствующие молекулярные орбитали формируются из одной 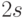 АО.
В 1983 г. были синтезированы молекулы
АО.
В 1983 г. были синтезированы молекулы  , имеющие форму додекаэдра (
рис.
5.3 справа). Атомы углерода в составе этой молекулы образуют грани в виде правильных пятиугольников с углами
, имеющие форму додекаэдра (
рис.
5.3 справа). Атомы углерода в составе этой молекулы образуют грани в виде правильных пятиугольников с углами  . Это показывает, что внешняя электронная оболочка атома углерода еще более лабильна, чем казалось раньше, и в соответствующих условиях может образовать еще более сложные гибридные орбитали.
. Это показывает, что внешняя электронная оболочка атома углерода еще более лабильна, чем казалось раньше, и в соответствующих условиях может образовать еще более сложные гибридные орбитали.
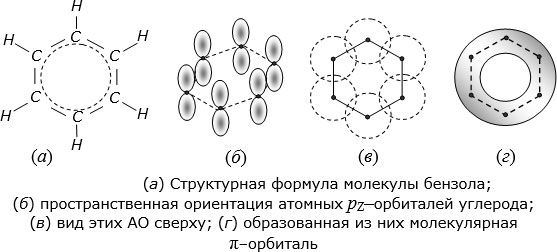
В состоянии 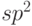 -гибридизации атомы углерода легко образуют кольцевые структуры, наиболее известной из которых является бензольное кольцо (
рис.
5.4).
-гибридизации атомы углерода легко образуют кольцевые структуры, наиболее известной из которых является бензольное кольцо (
рис.
5.4).
Две из трех гибридных  -орбиталей каждого атома углерода в этом кольце образуют ковалентные
-орбиталей каждого атома углерода в этом кольце образуют ковалентные 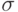 -связи с соседними атомами углерода, а третья –
-связи с соседними атомами углерода, а третья – 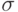 -связь с атомом водорода. Атомные
-связь с атомом водорода. Атомные 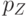 -орбитали атомов углерода ориентированы перпендикулярно к плоскости кольца (
рис.
5.4,б; плоскость кольца изображена штриховыми отрезками). Вид этих АО сверху показан штриховыми кругами на
рис.
5.4,в. Черными точками показаны положения ионов
-орбитали атомов углерода ориентированы перпендикулярно к плоскости кольца (
рис.
5.4,б; плоскость кольца изображена штриховыми отрезками). Вид этих АО сверху показан штриховыми кругами на
рис.
5.4,в. Черными точками показаны положения ионов  . Объединение
. Объединение 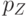 -орбиталей соседних атомов углерода приводит к образованию связывающей молекулярной
-орбиталей соседних атомов углерода приводит к образованию связывающей молекулярной 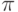 -орбитали, показанной в плане как серое кольцо на
рис.
5.4,г. Она состоит из двух зеркально симметричных половинок: одна над, другая – под плоскостью кольца. Все шесть
-орбитали, показанной в плане как серое кольцо на
рис.
5.4,г. Она состоит из двух зеркально симметричных половинок: одна над, другая – под плоскостью кольца. Все шесть 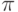 -электронов "размазаны" по этой орбитали и принадлежат не отдельным атомам углерода, а всему кольцу.
-электронов "размазаны" по этой орбитали и принадлежат не отдельным атомам углерода, а всему кольцу.
Скрепленное 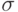 -связями между парами соседних атомов углерода и общей для всего кольца молекулярной
-связями между парами соседних атомов углерода и общей для всего кольца молекулярной 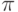 -орбиталью, бензольное кольцо диаметром приблизительно 0,3 нм оказалось удивительно стойким и прочным и стало конструктивной основой и "строительным блоком" сотен тысяч разных органических молекул.
-орбиталью, бензольное кольцо диаметром приблизительно 0,3 нм оказалось удивительно стойким и прочным и стало конструктивной основой и "строительным блоком" сотен тысяч разных органических молекул.
Как видим, атомы углерода могут выступать во многих разных химических "ипостасях". По многообразию возможных химических связей им нет равных среди всех других элементов периодической системы. Недаром же они стали одной из непременных основ всей органической жизни на Земле.