| Россия |
ППР-сенсоры Spreeta. Съемные рецепторные чипы. ППР-иммуносенсоры и волоконно-оптические сенсоры
24.3. Пример использования ППР иммуносенсора для выявления заболевания коров на лейкоз
В качестве наглядного примера эффективности применения ППР сенсоров для выявления возбудителей болезней рассмотрим ППР иммуносенсор для анализа заболевания коров на лейкоз [ [ 191 ] , [ 277 ] ].
Известно, что ретровирусы являются возбудителями приобретенного иммунодефицита у людей (СПИДа). Один из их подвидов является также возбудителем вирусного лейкоза большого рогатого скота. Это заболевание может передаваться от коров человеку через употребление молока. Сейчас в мире идет поиск эффективных методов борьбы с ретровирусными инфекциями. Но, к сожалению, эффективного лечения пока не существует. Основной мерой борьбы с инфекционным лейкозом являются постоянная диагностика животных, своевременное выявление больных особей и их изоляция от стада коров. Для этого нужны эффективные средства диагностики. Общепринятым сейчас методом выявления этого заболевания является иммуноферментный анализ (метод "Elisa") проб крови, взятой из шейной вены животных. Метод требует для анализа до 6 ч., достаточно сложен, требует профессиональной подготовки исполнителей, нуждается в спецоборудовании и спецреагентах. Стоимость одного анализа составляет свыше 5 долларов США. Все это не дает возможности вести постоянный мониторинг за состоянием животных, тогда как эффективное оздоровление стада коров в случае выявления в нем больных особей требует обследования каждой коровы по крайней мере через каждые 10 дней. Существующими методами это осуществить тяжело, как из-за высокой стоимости анализов, так и из-за проблемы частого взятия проб крови.
Возможность применения ППР сенсора для выявления наличия ретровирусов лейкоза в молоке коров была показана в Институте биохимии НАН Украины [
[
126
]
,
[
311
]
]. Когда в молоке присутствовало заметное количество ретровирусов, резонансный минимум на кривой ППР смещался приблизительно на 1  .
.
Учитывая потребность массового использования иммуносенсоров лейкоза коров в тысячах разных мест (на молочных фермах, в пунктах приема молока и т.д.), надо было создать относительно дешевый портативный ППР сенсор, предназначенный специально для выявления этого заболевания. Такой сенсор должен обеспечивать:
- прямой анализ, без использования дополнительных реагентов;
- экспрессность;
- анализ без взятия крови, по капле молока;
- дешевый анализ, стоимостью меньше 1 доллара США;
- небольшие габариты и массу (до 1 кг и меньше);
- быть удобным для использования в полевых условиях и пригодным для обычного транспортирования;
- выполнять всю необходимую обработку данных измерений внутри прибора и выдавать результаты анализов на свой индикатор;
- не нуждаться в высококвалифицированном обслуживающем персонале;
- иметь довольно высокую производительность – порядка 50 анализов/час;
- иметь не очень высокую стоимость, доступную для фермеров и малых предприятий.
На первом этапе нужен был недорогой сенсор-индикатор, который лишь обнаруживает присутствие в молоке значительного количества ретровирусов лейкоза, возможно, определяя 1-3 степени зараженности. В нем угловая разрешающая способность может быть порядка 0,5  .
.
На рис. 24.9 показана конструкция оптоэлектронной части разработанного ППР иммуносенсора, ориентированного на выявление заболевания коров на лейкоз. Полупроводниковый лазер 1, две поляризационные стопы 2, установленные встречно, и диафрагма 3 вместе образуют узел формирования параллельного пучка света с требуемой поляризацией (осветительный узел). Оптический узел для анализа пробы состоит из оптической ретропризмы 4, съемного рецепторного чипа 5, зеркальной грани 6 и оправы 7. Фотоприемный узел состоит из фотоприемника 8 и собирающей линзы 9.

Рис. 24.9. Конструкция оптоэлектронной части ППР иммуносенсора для выявления заболевания коров на лейкоз
Осветительный и фотоприемный узлы смонтированы внутри подвижных поворотных цилиндров 10 и 11. Они размещены в параллельных цилиндрических каналах, образованных в металлическом корпусе 12, который объединяет их в отдельный конструктивный блок. Последний отделен от ретропризмы 4 с оправой 7 воздушным промежутком 13 шириной 2-3 мм. Упругая перемычка 14 и микрометрический винт 15 позволяют регулировать угол падения света на ретропризму в пределах приблизительно  2,50 (при изготовлении). Для защиты от загрязнений, механических повреждений и влияния внешнего света при хранении, перевозке и во время измерений узел анализа пробы закрывают непрозрачной крышкой 16.
2,50 (при изготовлении). Для защиты от загрязнений, механических повреждений и влияния внешнего света при хранении, перевозке и во время измерений узел анализа пробы закрывают непрозрачной крышкой 16.
В этом ППР иммуносенсоре применен полупроводниковый лазер KLM-650/3 с углом расхождения светового пучка менее 0,04  , мощностью
, мощностью 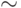 3 мВт, с длиной волны
3 мВт, с длиной волны 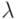 = 650 нм и монохроматичностью
= 650 нм и монохроматичностью 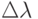 = 0,5 нм.
= 0,5 нм.
На рис. 24.10 показан внешний вид ППР иммуносенсора со стороны грани призмы, на которой установлен "рецепторный" чип 3 с пленкой золота.
При регулировании угла падения света на ретропризму световые пучки, которые входят и выходят из нее, остаются параллельными. Благодаря параллельности оптических осей фотоприемного и осветительного узлов они всегда попадают на фотоприемник.
В процессе работы грань ретропризмы, на которую устанавливают рецепторный чип, размещается горизонтально. Перед измерением на рецепторные чипы (вне ППР сенсора) наносят каплю контролируемого молока и выдерживают в течение заданного времени, требуемого для химического присоединения ретровирусов лейкоза к специфичным к ним антителам, нанесенным на рецепторный чип. Время выдерживания составляет от 2 до 20 мин. в зависимости от активности нанесенного на чип лиганда и от температуры. "Созревший" рецепторный чип ставят на рабочее место в ППР сенсоре, смоченное иммерсионной жидкостью, и проводят измерение. На это требуется 10-30 с. Потом в ППР иммуносенсор ставят следующий "созревший" рецепторный чип и проводят его измерение. Можно выполнить до 100 анализов за час.

Рис. 24.10. Вид ППР иммуносенсора лейкоза коров сверху: 1 – поворотный блок с лазером и фотоприемником; 2 – призма; 3 – рецепторный чип с золотой пленкой
В данном иммуносенсоре полная кривая ППР не снимается. Проводится лишь 3-кратное измерение интенсивности отраженного света при фиксированном угле падения. Принцип измерения объясняется на
рис.
24.11, где показаны две кривые ППР. Кривая 1 получается при нанесении на рецепторный чип "чистого" (т.е. без вирусов) молока. При угле падения 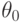 , с которым работает прибор, интенсивность отраженного света
, с которым работает прибор, интенсивность отраженного света  , приходящего на фотодетектор 3, является минимальной. Если же исследуемое молоко содержит определенное количество вирусов, то кривая ППР смещается, например, как показано штриховой линией (кривая 2).
Минимум кривой теперь находится при угле
, приходящего на фотодетектор 3, является минимальной. Если же исследуемое молоко содержит определенное количество вирусов, то кривая ППР смещается, например, как показано штриховой линией (кривая 2).
Минимум кривой теперь находится при угле  . Поэтому при неизменном угле падения
. Поэтому при неизменном угле падения 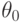 интенсивность отраженного света
интенсивность отраженного света  становится уже значительно большей. И чем больше ретровирусов находится в исследуемом молоке, тем больше будет сигнал от фотодетектора. Таким образом, измеряя этот сигнал, можно строить заключения относительно наличия и концентрации в молоке ретровирусов лейкоза.
становится уже значительно большей. И чем больше ретровирусов находится в исследуемом молоке, тем больше будет сигнал от фотодетектора. Таким образом, измеряя этот сигнал, можно строить заключения относительно наличия и концентрации в молоке ретровирусов лейкоза.

Рис. 24.11. Объяснение принципа действия сенсора: 1 - кривая ППР для "чистой" пробы; 2 - кривая ППР в случае наличия в молоке ретровирусов лейкоза
Сделав измерение "эталонных" растворов с известными концентрациями аналита, можно проградуировать прибор, т.е. найти зависимость между концентрацией вирусов лейкоза и величиной сигнала от фотодетектора. Эта зависимость запоминается в микропроцессоре, и с его помощью выдаются на индикатор портативного прибора результаты анализа.
Выше отмечалось, что в полевых условиях из-за наличия пыли неопределенность положения рецепторного чипа относительно грани призмы составляет примерно  0,3
0,3  . Связанные с этим погрешности показаны на
рис.
24.12.
. Связанные с этим погрешности показаны на
рис.
24.12.

Рис. 24.12. Смещение кривой ППР в зависимости от ориентации рецепторного чипа: 1 – кривая ППР при точной ориентации чипа; 2 – при отклонении на – 0,3 ; 3 – при отклонении на + 0,3 ; 4 – при отклонении на + 0,6
Кривая 1 наблюдается при точной ориентации. При отклонении ориентации рецепторного чипа от этой точной на – 0,3  будет фактически регистрироваться кривая 2, при отклонении на угол + 0,3
будет фактически регистрироваться кривая 2, при отклонении на угол + 0,3  (в другую сторону) – кривая 3, при отклонении на угол 0,6
(в другую сторону) – кривая 3, при отклонении на угол 0,6  – кривая 4. В случае точной ориентации рецепторного чипа измеряется интенсивность отраженного света
– кривая 4. В случае точной ориентации рецепторного чипа измеряется интенсивность отраженного света  . При неконтролируемом отклонении ориентации чипа на – 0,3
. При неконтролируемом отклонении ориентации чипа на – 0,3  измеряется интенсивность
измеряется интенсивность  . Поэтому, в диапазоне интенсивностей от
. Поэтому, в диапазоне интенсивностей от  до
до  мы не можем определить, с чем связанно увеличение интенсивности: со сдвигом кривой ППР из-за наличия вирусов лейкоза или с отклонением в ориентации рецепторного чипа.
Это означает, что те концентрации аналита, которые приводят к сдвигу кривой ППР на углы, меньше 0,3
мы не можем определить, с чем связанно увеличение интенсивности: со сдвигом кривой ППР из-за наличия вирусов лейкоза или с отклонением в ориентации рецепторного чипа.
Это означает, что те концентрации аналита, которые приводят к сдвигу кривой ППР на углы, меньше 0,3  , лежат уже за пределом чувствительности ППР сенсора. Лишь когда измеренная интенсивность отраженного света будет больше чем
, лежат уже за пределом чувствительности ППР сенсора. Лишь когда измеренная интенсивность отраженного света будет больше чем  мы можем быть уверены, что в контролируемом молоке находятся вирусы лейкоза.
мы можем быть уверены, что в контролируемом молоке находятся вирусы лейкоза.
Таким образом, случайный угол отклонения в ориентации чипа ограничивает порог чувствительности ППР иммуносенсора.
Когда измеренная интенсивность отраженного света превышает значение  , то мы можем быть уверены в том, что концентрация ретровирусов лейкоза превысила уже двойную пороговую концентрацию. Но чему именно равна концентрация, – сказать нельзя. Поэтому при наличии неконтролируемых отклонений в ориентации съёмных рецепторных чипов в пределах
, то мы можем быть уверены в том, что концентрация ретровирусов лейкоза превысила уже двойную пороговую концентрацию. Но чему именно равна концентрация, – сказать нельзя. Поэтому при наличии неконтролируемых отклонений в ориентации съёмных рецепторных чипов в пределах  0,3
0,3  ППР иммуносенсор можно использовать только как сенсор-индикатор наличия лейкоза. Он способен определить наличие вирусов лейкоза с концентрацией, выше пороговой и с концентрацией, выше двойной пороговой.
ППР иммуносенсор можно использовать только как сенсор-индикатор наличия лейкоза. Он способен определить наличие вирусов лейкоза с концентрацией, выше пороговой и с концентрацией, выше двойной пороговой.
Положительными чертами описанного ППР иммуносенсора являются его небольшие габариты и возможность его настройки на обнаружение в жидкости и других вирусов или на другие анализы, – путем использования других специфических рецепторных чипов с другими специфическими антителами и регулирования угла падения света на ретропризму. Например, в [ [ 267 ] ] описан метод формирования рецепторного слоя, позволяющего выполнять экспресс-диагностику туберкулеза большого рогатого скота, в [ [ 28 ] ] – рецепторного слоя, чувствительного к вирусам человеческого гепатита, в [ [ 130 ] ] – чувствительного к стафилококковым патогенам.

