| Россия |
Нейроподобные модели как формально-логический базис анализа живых систем
8.3. Криптостойкость как синоним специфичности молекулярно-биологических комплексов
Включение этапа синтеза супрамолекулярной гетероструктуры в полный жизненный цикл ее использования автоматически ставит вопрос о воспроизводимости таких структур по ходу вычислений. Для ответа на этот вопрос проанализируем возможности репродуктивного синтеза внутриклеточных белков с позиций криптостойкости молекулярно-биологического кода, обеспечивающего инструктированный синтез.
Успехи молекулярной биологии и генной инженерии отодвинули на второй план так и не решенную проблему синтеза in vitro белка, функционально идентичного белку, полученному in vivo (нативный белок). Молекулярные биологи не теряют надежды на разрешимость этой проблемы и поэтому говорят только о ее нерешенности, связывая последнюю с высочайшей специфичностью механизмов ферментативного синтеза [191, 219] и, как следствие, синтезированных макромолекул белка. Значительный прогресс в области нанотехнологий [95] способен возродить надежду на разрешение этой проблемы. Однако нанотехнологические инструментальные средства позволяют воспроизвести только первичную (линейную) структуру белков, функциональные свойства которых в значительной степени определяются еще и си стемой допустимых конфор-мационных преобразований, непрерывно изменяющих вторичную (пространственную) структуру не только макромолекул нативных белков, но и молекулярно-биологических комплексов, участвующих в их синтезе [234, 235]. Поэтому имеются достаточные основания считать, что синтез
макромолекул белка проводится "ненадежными" методами и средствами из "ненадежных" компонент, что и делает неразрешимой проблему репродуктивного синтеза самих нативных белков, функционально идентичных друг другу.
Покажем комбинаторную неразрешимость проблемы репродуктивного инструктированного синтеза функционально идентичных нативных белков, если специфичность молекулярно-биологических комплексов, участвующих в синтезе, рассматривать как их криптостойкость.
В такой постановке задачи оцениваемый на криптостойкость абстрактный молекулярно-биологический код, комплекс и так далее считается адекватным реальному молекулярно-биологическому коду, комплексу и так далее в той и только той степени, в какой использованные при формализации определения, допущения и (численные) ограничения адекватны реальным.
В первом приближении криптостойкость всех компонентов синтеза можно оценить неопределенностью их вторичных структур, которая зависит от соотношения мощностей пространства допустимых и пространства возможных конформационных преобразований. У абстрактных моделей это соотношение может оказаться как выше, так и ниже, чем у реальных молекулярно-биологических комплексов. Поэтому выводы о крипто-стойкости абстрактных моделей молекулярно-биологических комплексов нельзя напрямую распространять на их реальные прототипы.
Молекулярно-биологические предпосылки. Общепризнанная схема инструктированного синтеза нативных белков "один ген - один фермент - один белок" с формальных позиций говорит о том, что специфичность продукта синтеза (белков) в конечном счете определяется специфичностью базового инструмента синтеза (ферментов), которая в свою очередь определяется специфичностью инструкций, управляющих синтезом (генов). Отсюда встают две задачи оценки:
- исходной криптостойкости формальной модели молекулярно-биологического кода с неизменной первичной (алгебраической) структурой и непрерывно модифицируемой вторичной (геометрической) структурой;
- степени влияния системы преобразований, которые реализуются в процессе синтеза нативных белков, на итоговую криптостой-кость молекулярно-биологических структур и комплексов, которая определяется уровнем неопределенности их вторичных, третичных и даже четвертичных структур.
По Уотсону - Крику, генетическая память (ДНК-память) представляет собой сдвоенную спираль комплементарных пар оснований "аденина-тимина" (А-Т) и "гуанина-цитозина" (Г-Ц), которые в процессе
транскрипции однозначно копируются в последовательность комплементарных оснований информационной РНК (кодонов 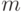 -РНК) с безусловным замещением тимина (Т) на урацил (У). Далее кодоны
-РНК) с безусловным замещением тимина (Т) на урацил (У). Далее кодоны 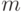 -РНК транслируются на рибосомах в 20-символьный код аминокислотных остатков с помощью комплементарных антикодонов транспортной РНК (
-РНК транслируются на рибосомах в 20-символьный код аминокислотных остатков с помощью комплементарных антикодонов транспортной РНК (  -РНК), которые и "нагружены" этими аминокислотами [230]. Поэтому есть достаточные основания считать:
-РНК), которые и "нагружены" этими аминокислотами [230]. Поэтому есть достаточные основания считать:
- непрерывно выполняемые конформационные преобразования структуры ДНК способны изменить только начальную пространственную ориентацию нуклеотидов синтезируемой
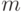 -РНК;
-РНК; - в основе инструктированного синтеза биологических макромолекул лежат биофизические и биохимические процедуры взаимного узнавания (идентификации) компонентов-посредников, которые обеспечивают подстановку (с непрерывно варьируемыми начальными условиями) элементарного субстрата в синтезируемые макромолекулы.
Базовые гипотезы:
- в метаболических процессах отношение комплементарности кодо-нов и антикодонов постоянно нарушается и может быть поддержано только на ограниченных интервалах времени специфическими механизмами транскрипции и трансляции генетического кода;
- конформационные преобразования носят циклический характер, и каждое из них используется только один раз в пределах одного временного цикла;
- в процессе инструктированного синтеза каждому допустимому кон-формационному преобразованию ДНК ставится во взаимно однозначное соответствие некоторое конформационное преобразование синтезируемой макромолекулы нативного белка.
Первая гипотеза отталкивается от эволюционного подхода к становлению механизмов транскрипции и трансляции [34], в рамках которого считается, что на предбиологическом этапе доступны были только механизмы самоорганизации диссипативных структур [33]. Высокоспецифичные механизмы взаимной идентификации, составляющие операционный базис инструктированного синтеза макромолекул белка, сформировались только на более позднем, биологическом этапе эволюции, и им соответствуют преобразования, сохраняющие отношение комплементарности на интервалах времени, достаточных для транскрипции и трансляции биологического кода.
Вторая гипотеза предполагает синхронный характер процессов, где все конформационные преобразования триплетов выполняются одновременно и с равной скоростью. В реальных условиях преобразование вторичных структур молекулярно-биологических комплексов носит асин-
хронный характер, что в алгебраическом представлении соответствует генерации с повторениями последовательностей виртуальных символов и дифтонгов. В технике такое поведение описывается полугрупповыми автоматами [220], операционное ядро которых формируют "простые" групповые автоматы, генерирующие последовательности символов без повторений. Поэтому оценки криптостойкости молекулярно-биологического кода, полученные на основе циклической синхронной модели, следует считать минимальными.
Третья гипотеза не имеет прямого экспериментального подтверждения, но она позволяет численно оценить предельные характеристики хорошо известного из практики структурно-функционального полиморфизма нативных белков.
Условие взаимной идентификации компонентов-посредников является необходимым, но не достаточным для синтеза биологических макромолекул. Тем не менее оно позволяет сформулировать условия устойчивости процедур синтеза нативных белков в терминах системы преобразований (много)пороговой модели (8.4).
Процедуры подстановки аминокислоты в макромолекулу белка можно считать устойчивыми, если конформационные преобразования непрерывно изменяют идентификационную активность триплетов только в пределах подклассов вырожденности биологического кода (необходимое условие) и только при сохранении константы комплементарности 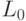 (достаточное условие). Такие конформационные преобразования и представляющие их вариации взвешенной идентификационной активности кодонов
(достаточное условие). Такие конформационные преобразования и представляющие их вариации взвешенной идентификационной активности кодонов 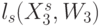 будем относить к допустимым.
будем относить к допустимым.
В общем случае конформационные преобразования могут нарушать константу комплементарности 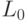 , что соответствует сохранению структуры, но не функции сдвоенного триплета. Преобразования, сохраняющие только структуру кодонов и ДНК-цепочек, и представляющие их вариации взвешенной идентификационной активности кодонов
, что соответствует сохранению структуры, но не функции сдвоенного триплета. Преобразования, сохраняющие только структуру кодонов и ДНК-цепочек, и представляющие их вариации взвешенной идентификационной активности кодонов  будем относить к возможным, и они включают допустимые преобразования в качестве подмножества.
будем относить к возможным, и они включают допустимые преобразования в качестве подмножества.
Оценка криптостойкости. В контексте решаемой задачи важны не сами непрерывные и непрерывно выполняемые конформационные преобразования, а их "алгебраические" последствия, которые можно оценить количеством порождаемых последовательностей идентификационных активностей триплетов ( виртуальных символов 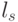 биологического кода).
биологического кода).
В одиночных триплетах и их последовательностях нас интересуют только конформационные преобразования, которые сохраняют отношение вырожденности биологического кода, заданного таблицей 8.2.
Конформационные преобразования из этого класса, последовательно выполненные над одиночным триплетом в произвольном порядке, но без повторений во временном цикле длины 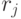 , способны породить множество последовательностей виртуальных символов
, способны породить множество последовательностей виртуальных символов 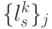 биологического кода фак-ториальной мощности:
биологического кода фак-ториальной мощности:  !, где
!, где  - вырожденность кодона, кодирующего
- вырожденность кодона, кодирующего 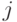 -ю аминокислоту.
-ю аминокислоту.
В частности, подкласс вырожденности аминокислоты ЛЕЙ включает 6 триплетов. Поэтому переходный процесс, обусловленный конформаци-онными преобразованиями, сохраняющими отношение вырожденности любого из триплетов этого подкласса, способен породить 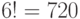 последовательностей виртуальных символов генетического кода с 6 начальными состояниями.
последовательностей виртуальных символов генетического кода с 6 начальными состояниями.
Подклассы вырожденности кодонов и антикодонов совпадают только частично (табл. 8.4).
Поэтому если взаимодействие в сдвоенных триплетах поддерживается только на структурном уровне, обеспечивающем устойчивость ДНК-спирали, то конформационные преобразования над кодонами и антикодонами могут выполняться независимо, что может привести к нарушению константы комплементарности 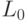 . В таких условиях пространство возможных состояний сдвоенного триплета задается разнообразием возможных комбинаций сдвоенных виртуальных символов
. В таких условиях пространство возможных состояний сдвоенного триплета задается разнообразием возможных комбинаций сдвоенных виртуальных символов  , мощность которого равна
, мощность которого равна 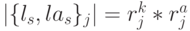 , где
, где 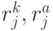 - количество значений идентификационной активности в подклассах вырожденности кодона и антикодона, отвечающих
- количество значений идентификационной активности в подклассах вырожденности кодона и антикодона, отвечающих 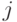 -й аминокислоте. В общем случае
-й аминокислоте. В общем случае 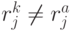 . Тогда мощ-ность множества возможных последовательностей виртуальных дифтонгов (без повторений в одном временном цикле длиной
. Тогда мощ-ность множества возможных последовательностей виртуальных дифтонгов (без повторений в одном временном цикле длиной  ) характеризует разнообразие переходных процессов в сдвоенном триплете и оценивается соотношением:
) характеризует разнообразие переходных процессов в сдвоенном триплете и оценивается соотношением: 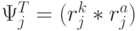 !.
!.
В частности, антикодоны аминокислоты ЛЕЙ образуют три подкласса вырожденности мощности 2 каждый, которые соответствуют аминокислотам ГЛУ, АСП и ЛИЗ. Поэтому вне зависимости от антико-дона переходный процесс в таком сдвоенном ДНК-триплете способен породить 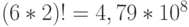 последовательностей виртуальных дифтонгов генетического кода с
последовательностей виртуальных дифтонгов генетического кода с  начальными состояниями.
начальными состояниями.
Во время транскрипции и трансляции конформационные преобразования кодонов и антикодонов должны сохранять не только вырожденность, но и константу комплементарности 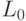 на всем множестве допусти-мых преобразований. В этом случае:
на всем множестве допусти-мых преобразований. В этом случае:
- пространство состояний триплета определяется минимальным разнообразием виртуальных дифтонгов, которое ограничено теоретико-множественным пересечением подмножеств идентификационных активностей кодона и антикодона:

- множество порождаемых переходным процессом допустимых последовательностей виртуальных дифтонгов оценивается соотношением
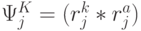 !, где всегда
!, где всегда 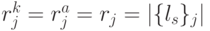 .
.
случае аминокислоты ЛЕЙ отдельные конформационные преобразования сдвоенного триплета способны породить  допустимые комбинации значений идентификационной активности, которым отвечает переходный процесс из
допустимые комбинации значений идентификационной активности, которым отвечает переходный процесс из 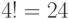 допустимых последовательностей виртуальных дифтонгов.
допустимых последовательностей виртуальных дифтонгов.
Отсюда, пространство устойчивых состояний сдвоенного триплета аминокислоты ЛЕЙ всего в 3 раза меньше пространства его возможных состояний, а разнообразие допустимых переходных процессов фактически "тонет" в разнообразии возможных переходных процессов во вторичной структуре ДНК (  ).
).
Таким образом, криптостойкость генетического кода поддерживается (гипер)высоким соотношением мощностей пространств возможных и допустимых конформационных преобразований, начиная с уровня преобразования символов.
Отсутствие у нативных белков изомеров говорит о том, что их устойчивому синтезу отвечает декартово произведение дифтонгов 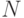 -го порядка, которое определено на множестве допустимых переходных процессов идентификационных активностей комплементарных пар:
-го порядка, которое определено на множестве допустимых переходных процессов идентификационных активностей комплементарных пар:

Здесь 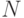 - количество аминокислот в произвольной ^-макромолекуле белка.
- количество аминокислот в произвольной ^-макромолекуле белка.
В частности, только в одной полипептидной  -цепи гемоглобина человека содержится
-цепи гемоглобина человека содержится 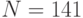 аминокислотный остаток [22]: ВАЛ-ЛЕЙ-СЕР-ПРО-АЛА-АСП-ЛИЗ-ТРЕ-АСП-NH2-ВАЛ-ЛИЗ-АЛА-АЛА-ТРИ-ГЛИ-ЛИЗ-ВАЛ-ГЛИ-АЛА-ГИС-АЛА-ГЛИ-ГЛУ-ТИР-ГЛИ-АЛА-ГЛУ-АЛА-ЛЕЙ-ГЛУ-АРГ-МЕТ-ФЕН-ЛЕЙ-СЕР-ФЕН-ПРО-ТРЕ-ТРЕ-ЛИЗ-ТРЕ-ТИР-ФЕН-ПРО-ГИС-ФЕН-АСП-ЛЕЙ-СЕР-ГИС-ГЛИ-СЕР-АЛА-ГЛУ-NH2-ВАЛ-ЛИЗ-ГЛИ-ГИС-ГЛИ-ЛИЗ-ЛИЗ-ВАЛ-АЛА-АСП-АЛА-ЛЕЙ-ТРЕ-АСП-NH2-АЛА-ВАЛ-АЛА-ГИС-ВАЛ-АСП-АСП-МЕТ-ПРО-АСП-NH2-АЛА-ЛЕЙ-СЕР-АЛА-ЛЕЙ-СЕР-АСП-ЛЕЙ-ГИС-АЛА-ГИС-ЛИЗ-ЛЕЙ-АРГ-ВАЛ-АСП-ПРО-ВАЛ-АСП-ФЕН-ЛИЗ-ЛЕЙ-ЛЕЙ-СЕР-ГИС-ЦИС-ЛЕЙ-ЛЕЙ-ВАЛ-ТРЕ-ЛЕЙ-АЛА-АЛА-ГИС-ЛЕЙ-ПРО-АЛА-ГЛУ-ФЕН-ТРЕ-ПРО-АЛА-ВАЛ-ГИС-АЛА-СЕР-ЛЕЙ-АСП-ЛИЗ-ФЕН-ЛЕЙ-АЛА-СЕР-ВАЛ-СЕР-ТРЕ-ВАЛ-ЛЕЙ-ТРЕ-СЕР-ЛИЗ-ТИР-АРГ.
аминокислотный остаток [22]: ВАЛ-ЛЕЙ-СЕР-ПРО-АЛА-АСП-ЛИЗ-ТРЕ-АСП-NH2-ВАЛ-ЛИЗ-АЛА-АЛА-ТРИ-ГЛИ-ЛИЗ-ВАЛ-ГЛИ-АЛА-ГИС-АЛА-ГЛИ-ГЛУ-ТИР-ГЛИ-АЛА-ГЛУ-АЛА-ЛЕЙ-ГЛУ-АРГ-МЕТ-ФЕН-ЛЕЙ-СЕР-ФЕН-ПРО-ТРЕ-ТРЕ-ЛИЗ-ТРЕ-ТИР-ФЕН-ПРО-ГИС-ФЕН-АСП-ЛЕЙ-СЕР-ГИС-ГЛИ-СЕР-АЛА-ГЛУ-NH2-ВАЛ-ЛИЗ-ГЛИ-ГИС-ГЛИ-ЛИЗ-ЛИЗ-ВАЛ-АЛА-АСП-АЛА-ЛЕЙ-ТРЕ-АСП-NH2-АЛА-ВАЛ-АЛА-ГИС-ВАЛ-АСП-АСП-МЕТ-ПРО-АСП-NH2-АЛА-ЛЕЙ-СЕР-АЛА-ЛЕЙ-СЕР-АСП-ЛЕЙ-ГИС-АЛА-ГИС-ЛИЗ-ЛЕЙ-АРГ-ВАЛ-АСП-ПРО-ВАЛ-АСП-ФЕН-ЛИЗ-ЛЕЙ-ЛЕЙ-СЕР-ГИС-ЦИС-ЛЕЙ-ЛЕЙ-ВАЛ-ТРЕ-ЛЕЙ-АЛА-АЛА-ГИС-ЛЕЙ-ПРО-АЛА-ГЛУ-ФЕН-ТРЕ-ПРО-АЛА-ВАЛ-ГИС-АЛА-СЕР-ЛЕЙ-АСП-ЛИЗ-ФЕН-ЛЕЙ-АЛА-СЕР-ВАЛ-СЕР-ТРЕ-ВАЛ-ЛЕЙ-ТРЕ-СЕР-ЛИЗ-ТИР-АРГ.
В результате во время синтеза полипептида а-цепи отвечающий ей фрагмент ДНК может находиться в любом из  допустимых состояний, определяемых допустимыми уровнями идентификационной активности составляющих комплементарных триплетов. Переходный процесс на таком множестве состояний способен породить
допустимых состояний, определяемых допустимыми уровнями идентификационной активности составляющих комплементарных триплетов. Переходный процесс на таком множестве состояний способен породить  допустимые последовательности виртуальных дифтонгов биологического кода. Здесь показатель степени за скобками соответствует вторичной спецификации а-цепи, то есть количеству триплетов в кодирующем фрагменте ДНК, которые порождают равномощные подмножества виртуальных дифтонгов или их последовательности, мощности которых проставлены внутри скобок.
допустимые последовательности виртуальных дифтонгов биологического кода. Здесь показатель степени за скобками соответствует вторичной спецификации а-цепи, то есть количеству триплетов в кодирующем фрагменте ДНК, которые порождают равномощные подмножества виртуальных дифтонгов или их последовательности, мощности которых проставлены внутри скобок.
В пределе функциональное многообразие а-цепи гемоглобина может быть взаимно однозначно связано с многообразием допустимых состояний кодирующей его цепи ДНК. В этом случае за время жизни Вселенной (  секунд) даже с невообразимо большой скоростью (141 кон-формационное преобразование за 1 фемтосекунду -
секунд) даже с невообразимо большой скоростью (141 кон-формационное преобразование за 1 фемтосекунду - 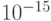 с) можно перебрать только ничтожно малую часть этого пространства состояний (
с) можно перебрать только ничтожно малую часть этого пространства состояний ( 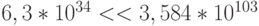 ).
).
Пространство возможных состояний того же фрагмента ДНК определяется количеством конформационных преобразований, сохраняющих только структурные связи сдвоенных кодонов, идентификационная активность которых может соответствовать условиям комплементарно-сти только в отдельные моменты времени. В результате фрагмент ДНК, кодирующий  -цепь, может находиться в одном из
-цепь, может находиться в одном из  возможных состояний.
возможных состояний.
Переходный процесс на таком множестве состояний способен породить  возможных последовательностей виртуальных дифтонгов биологического кода.
возможных последовательностей виртуальных дифтонгов биологического кода.
Таким образом, пространство возможных конформационных преобразований фрагмента ДНК, кодирующего относительно простую полипептидную  -цепь, более чем на 33 порядка превосходит пространство допустимых конформационных преобразований, сохраняющих отношение комплементарности и тем самым обеспечивающих устойчивый синтез этого полипептида. При этом разнообразие возможных переходных
процессов более чем на порядок превосходит разнообразие допустимых переходных процессов.
-цепь, более чем на 33 порядка превосходит пространство допустимых конформационных преобразований, сохраняющих отношение комплементарности и тем самым обеспечивающих устойчивый синтез этого полипептида. При этом разнообразие возможных переходных
процессов более чем на порядок превосходит разнообразие допустимых переходных процессов.
Отсюда, криптостойкость ДНК-кода настолько велика, что знание его структуры мало что дает не только для получения in vitro белка, функционально идентичного (и по начальному состоянию, и по переходному процессу) белку, синтезируемому in vivo, но и для репродуктивного инструктированного синтеза нативных белков. В любом случае для обеспечения функциональной идентичности требуется восстановить систему конформационных преобразований белка-прототипа из гиперкомбинаторного пространства возможных преобразований, что и делает эту задачу комбинаторно неразрешимой на интервалах времени, сопоставимых со временем жизни Вселенной.
Формальные аспекты организации ДНК-памяти. Репродуктивный инструктированный синтез функционально идентичных не только внеклеточных, но и нативных белков прямо или косвенно предполагает длительное надежное хранение информации о переходном процессе в ДНК на всем интервале синтеза белка-предшественника.
Хранить информацию в динамических системах с непрерывно изменяемым внутренним состоянием, как это имеет место в ДНК-памяти, можно двумя способами:
- организацией циклов в переходных процессах на подмножествах возможных состояний, из которых хотя бы одно является информативным (в нашем случае - сохраняющем требуемое
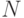 -мерное отношение комплементарности);
-мерное отношение комплементарности); - "замораживанием" динамических характеристик одного переходного процесса по отношению к другому (в нашем случае - переходного процесса в кодирующем участке ДНК по отношению к времени жизни макромолекулы белка).
В современной вычислительной технике первому способу хранения отвечает закольцованная FIFO -регистровая память, выход которой информативен только на некотором подмножестве, вообще говоря, произвольно
расположенных во времени тактах. ( FIFO - это "первый вошел - первый вышел".) Зависимость конформационных преобразований сдвоенных триплетов ДНК от внешних воздействующих факторов говорит о низкой надежности такой памяти и, как следствие, о малой вероятности репродуктивного синтеза на ее основе функционально идентичных макромолекул нативного белка, которая тем меньше, чем больше время его жизни.
"Замораживание" динамических характеристик переходного процесса в кодирующем участке ДНК достигается ингибированием как внутренних, так и внешних взаимодействий в ней, что снижает чувствительность конформационных преобразований к внешним воздействующим факторам, но требует биофизической и биохимической блокады кодирующих участков ДНК. Такая блокада негативно сказывается на многообразии и сложности нативных белков, которые могут одновременно принимать участие в метаболических процессах. Со временем такая блокада может привести к полному "замораживанию" всего генома клетки.
Отсюда, как и в любой (полу)открытой динамической системе, достаточно надежно хранить информацию о функционально идентичной версии макромолекулы нативного белка непосредственно в ДНК-памяти можно относительно недолго. Это говорит о том, что конформационные преобразования ДНК пригодны для организации работы памяти только временного хранения, в которой цикл достоверного воспроизводства информации в лучшем случае сопоставим со временем жизни макромолекулы нативного белка.
Такое ограничение на ДНК-память является прямым следствием "внутреннего" противоречия, заложенного в механизмы инструктированного синтеза нативного белка: информация о параметрах структуры одних молекулярно-биологических комплексов представляется в параметрах структуры других молекулярно-биологических комплексов, подверженных таким же "ненадежным" конформационным преобразованиям. Для преодоления этого противоречия необходимы вещества, которые удовлетворяют двум требованиям: их структура должна зависеть от конформационных преобразований белков-предшественников, а значит, и от конформационных преобразований ДНК, только на момент их синтеза, но их реакция на слабое идентификационное воздействие не должна зависеть от конформационных преобразований, которым они подвергаются в метаболических процессах. Фактически речь должна идти о качественно новых для вычислительной техники, структурно-параметрических методах и средствах хранения информации на основе PD -ассоциативных гетероструктур [232], в которые и закладывается информация о параметрах другой структуры.
В цитоплазме клетки структурно-параметрическое хранение информации организовано эпигенетическим путем [236], то есть прямой трансформацией (без непосредственного участия ДНК) параметров преоб-
разований вторичной и третичной структур белков-предшественников в первичную структуру белков-прионов, которые обнаружены при исследовании механизмов инфекционной передачи нейродегенеративных функций, обусловленной преобразованиями вторичной и третичной структуры белков-предшественников.
Главные достоинства прионов:
- прионы второго, третьего и так далее поколений сохраняют и передают (наследуют) информацию о конформационных преобразованиях белка-предшественника за счет его прямой репродукции, то есть синтезом "себе подобных";
- все поколения прионов обладают повышенной устойчивостью к ряду агентов, разрушающих прототипы.
Главное ограничение: эпигенетические методы и средства хранения информации тяготеют к спонтанному выращиванию прионных "кристаллов" с ярко выраженными нейродегенеративными функциями.
Таким образом, в клетке кроме ДНК- и РНК-памяти существуют еще и конформационные белковые матрицы, основное назначение которых - это поддержание репродуктивных функций клетки, а произошедшие при копировании белка-предшественника изменения его вторичной и третичной структуры являются негативным побочным эффектом. В пользу такой роли прионов говорит тот факт, что они могут и не иметь ничего общего по первичной структуре и функциям со своими предшественниками, то есть их основное назначение - это сохранение конформационной идентичности или хотя бы сходства с белком-предшественником в гиперкомбинаторном пространстве возможных конформационных преобразований.
С формальных позиций сходство делает эквивалентными те молекулярно-биологические комплексы, которые отличаются друг от друга ровно в д позициях, индифферентных по отношению к "активной" или "главной" функции макромолекулы белка. Количество сходных и в этом смысле эквивалентных последовательностей виртуальных дифтонгов длины 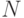 оценивается соотношением [124]
оценивается соотношением [124]
![B_{\delta}(r_{j},N,\delta) = C^{\delta}_{N}*\prod_j{[(r_j)^2 -1]}](/sites/default/files/tex_cache/098514206d1dbf58735597f7f7c6bed2.png)
для допустимых виртуальных дифтонгов и
![B_{\delta}(r_{j},N,\delta) = C^{\delta}_{N}*\prod_j{[r_j^k * r_j^a -1]}](/sites/default/files/tex_cache/d040fe5412b55f6176c9fb75a97ea7e1.png)
для возможных виртуальных дифтонгов, где  - число сочетаний из
- число сочетаний из 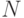 элементов по
элементов по 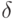 , а
, а 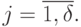
Эти соотношения говорят об экспоненциальном характере снижения размерности функционально значимого подпространства допустимых и
возможных состояний с ростом количества индифферентных позиций в кодирующем фрагменте ДНК, что и создает эффект снижения его размера до величины 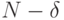 . В криптографии подобный эффект используется для "погружения" малого количества информативных символов в "большую" псевдослучайную последовательность.
. В криптографии подобный эффект используется для "погружения" малого количества информативных символов в "большую" псевдослучайную последовательность.
Таким образом, проведенные исследования криптостойкости молекулярно-биологического кода позволяют заключить:
- Совокупность генетических и эпигенетических методов и средств хранения информации в клетке способна обеспечить репродуктивное воспроизводство только сходных, но никак не тождественных по функциям нативных белков.
- В ДНК-коде можно идентифицировать только первичную структуру, но невозможно идентифицировать (расшифровать), а тем более сформировать функционально тождественную копию заранее заданной вторичной структуры, то есть вывести динамический процесс модификации вторичной структуры молекулярно-биологического комплекса в единственное заранее заданное состояние.
- Систематика синтеза нативных белков:
- феноменологические методы и средства самоорганизации диссипа-тивных структур пригодны только для синтеза сложных макромолекул предбиологического этапа эволюции;
- методами и средствами инструктированного синтеза можно создать только функционально полиморфные нативные белки, "прионная" коррекция которых позволяет выделить в них относительно небольшое количество функционально активных центров, адекватных текущим требованиям метаболического процесса.
