|
Добрый день! Я ранее заканчивал этот курс бесплатно. Мне пришло письмо что я могу по этому курсу получить удостоверение о повышении квалификации. Каким образом это можно сделать не совсем понятны шаги кроме как вновь записаться на этот курс. С уважением Жолондиевский Эрнесто Робертович. |
Меры информации в системе
3. Термодинамическая мера. Информационно-термодинамический подход связывает величину энтропии системы с недостатком информации о внутренней структуре системы (не восполняемым принципиально, а не просто нерегистрируемым). При этом число состояний определяет, по существу, степень неполноты наших сведений о системе.
Пусть дана термодинамическая система (процесс) S, а Н0, Н1 - термодинамические энтропии системы S в начальном (равновесном) и конечном состояниях термодинамического процесса, соответственно. Тогда термодинамическая мера информации (негэнтропия) определяется формулой:
Н(Н0,Н1)=Н0 - Н1.
Эта формула универсальна для любых термодинамических систем. Уменьшение Н(Н0,Н1) свидетельствует о приближении термодинамической системы S к состоянию статического равновесия (при данных доступных ей ресурсах), а увеличение - об удалении.
Поставим некоторый вопрос о состоянии термодинамической системы. Пусть до начала процесса можно дать p1 равновероятных ответов на этот вопрос (ни один из которых не является предпочтительным другому), а после окончания процесса - p2 ответов. Изменение информации при этом:
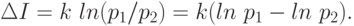
Если 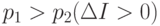 - идет прирост информации, т.е. сведения о системе стали более определенными, а при
- идет прирост информации, т.е. сведения о системе стали более определенными, а при 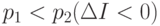 - менее определенными. Универсально то, что мы не использовали явно структуру системы (механизм протекания процесса).
- менее определенными. Универсально то, что мы не использовали явно структуру системы (механизм протекания процесса).
Пример. Предположим, что имеется развивающаяся социально-экономическая система с числом состояний 10, которая в результате эволюции развилась до системы с числом состояний 20. Нас интересует вопрос о состоянии некоторого составного элемента системы (например, предприятия). В начале мы знали ответ на вопрос и поэтому p1=1 (lnp1=0). Число ответов было пропорционально величине [ln10]. После развития мы знаем уже микроэкономическое состояние, т.е. изменение информации о состоянии системы равно  (нат).
(нат).
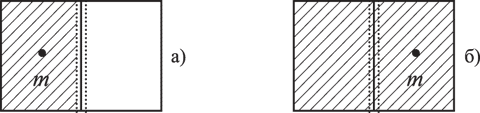
Пример. Предположим, что имеется термодинамическая система - газ в объеме V, который расширяется до объема 2V (рис. 6.1).
Нас интересует вопрос о координате молекулы m газа. В начале (а) мы знали ответ на вопрос и поэтому p1=1 (lnp1=0). Число ответов было пропорционально lnV. После поднятия заслонки мы уже знаем эту координату (микросостояния), т.е. изменение (убыль) информации о состоянии системы будет равно
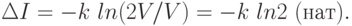
Мы получили известное в термодинамике выражение для прироста энтропии в расчете на одну молекулу, и оно подтверждает второе начало термодинамики. Энтропия - мера недостатка информации о микросостоянии статической системы.
Величина 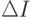 может быть интерпретирована как количество информации, необходимой для перехода от одного уровня организации системы к другому (при
может быть интерпретирована как количество информации, необходимой для перехода от одного уровня организации системы к другому (при  - более высокому, а при
- более высокому, а при 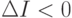 - более низкому уровню организации).
- более низкому уровню организации).
Термодинамическая мера ( энтропия ) применима к системам, находящимся в тепловом равновесии. Для систем, далеких от теплового равновесия, например, живых биологических систем, мера-энтропия - менее подходящая.