|
В структуре МЧС РФ имеется Департамент гражданской защиты, однако его руководитель не может быть первым заместителем руководителя гражданской защиты (Премьер-министра РФ); первым заместитетелем может быть скорее министр МЧС, но в этом случае организация гражданской защиты на федеральном уровне будет аналогична организации гражданской обороны (раздел 1.2 лекции). Необходимо привести материал в соответствие с существующими органами государственного управления РФ |
Ликвидация последствий чрезвычайных ситуаций
Методы, способы и общие основы обеззараживания
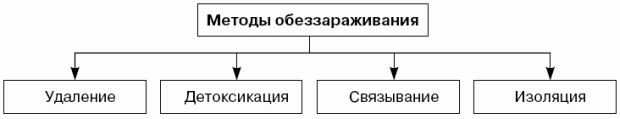
Методы обеззараживания
Удаление - это удаление загрязнений с зараженной поверхности или удаление самого зараженного объекта от человека.
Детоксикация - это химическое, термохимическое или биохимическое превращение загрязнения в малотоксичные соединения.
Связывание - это снижение подвижности загрязнения, уменьшение скорости испарения и предотвращение его переноса на окружающие объекты (т. е. уменьшение опасности вторичного заражения и попадания в организм человека).
Изоляция - это изоляция источника заражения от окружающей среды, а также покрытие зараженных поверхностей пленками и другими материалами.
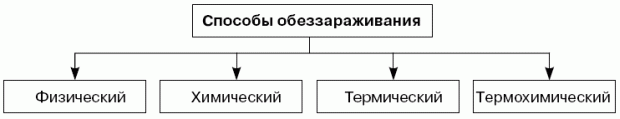
Способы обеззараживания
Кроме того, различают жидкостный и безжидкостный способы обеззараживания. Выбор способа зависит от загрязняющего вещества и его агрегатного состояния. Реализация этих способов осуществляется с использованием различных рабочих сред (рецептур, т. е. веществ или смесей веществ, активных по отношению к ОХВ, ОВ, РВ, БС) и технических средств специальной обработки (ТССО).
Твердые адгезионные загрязнения могут как удаляться физическим способом (сметанием, сдуванием, смыванием - в основном РВ), так и обеззараживаться химическим способом (ОВ, ОХВ, БС).
Удаление поверхностных жидких и газообразных загрязнений возможно только после преодоления адсорбционных сил путем сольватации молекулами растворителя (растворение) или повышением температуры поверхности.
Удаление глубинных загрязнений осуществляется путем стирки (с использованием экстрагентов - специальных растворителей) и сушки горячим воздухом.
Для удаления объемного загрязнения из воды или воздуха используют процессы фильтрации, сорбции и ионного обмена.
Термохимический способ детоксикации основан на подводе к зараженной поверхности высокоинтенсивных потоков энергии в виде излучения светового, ИК- и УФ-диапазонов или обработке высокотемпературной плазмой. При этом резко активируются процессы термодеструкции загрязнений (ОВ, ОХВ, БС) с образованием малотоксичных продуктов.
Химический способ основан на применении жидких химически активных рецептур.
Всю совокупность ОХВ можно условно свести к двум парам:
- первая - кислого характера, дающая в воде кислую среду (хлор, оксиды азота, оксиды серы и т. д.), и щелочного характера, дающая в воде щелочную среду (аммиак, амины и т. д.);
- вторая - окислители и восстановители (горючие вещества, гептил и т. д.).
В каждой паре вещества являются антагонистами и, следовательно, при эквивалентном взаимодействии нейтрализуют друг друга. Таким образом, подбор нейтрализующего вещества достаточно прост:
- для нейтрализации веществ кислого характера применяются вещества щелочного характера и, наоборот, для нейтрализации щелочи применяется кислота;
- для нейтрализации окислителя применяется восстановитель и наоборот.
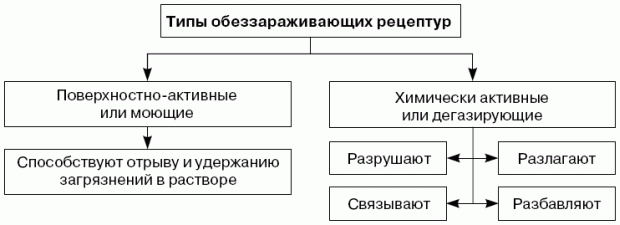
Обеззараживание различных поверхностей объектов в основном осуществляется с использованием рецептур двух типов.
Типы обеззараживающих рецептур
Разрушение основано на реакции между ОХВ и реагентом, химически активным по отношению к нему.
Связывание (поглощение) достигается применением адсорбционных материалов (грунт, песок, шлак и т. д.).
Разложение происходит в результате воздействия высоких температур.
Разбавление производится водой или растворами нейтральных веществ.
Вещества и растворы (рецептуры), применяемые для обеззараживания
Для обеззараживания ОХВ (ОВ) применяются рецептуры на основе веществ окислительно-хлорирующего (гипохлориты, хлорамины) и нуклеофильного действия (алкоголяты, щелочи). В качестве растворителей используют воду и органические растворители - сольвенты (дихлорэтан, спирты, бензин и др.).
Вещества, применяемые для приготовления обеззараживающих рецептур
Гипохлориты кальция (ГК) - технические продукты, активными компонентами которых являются гипохлорит кальция Са(ОСl)2 и гидрооксид кальция Са(ОН)2 , а примесями - хлорид и карбонат натрия. В зависимости от содержания активных компонентов различают:
- нейтральный гипохлорит кальция (НГК);
- дветретиосновной гипохлорит кальция (ДТСГК) x 3Са(ОСl)2 x 2Са(ОН)2 x 2Н2О (белый сыпучий порошок с запахом хлора; в воде растворяется умеренно, а в органических растворителях не растворяется).
ГК при растворении в воде образует ряд хлорактивных соединений (ОСl, НОСl, СlO2, Cl2), действие которых на ОХВ (ОВ) приводит, как правило, к образованию малотоксичных продуктов.
Технические гипохлориты используют для дегазации в виде водных суспензий, кашицы и сухого порошка.
Гипохлорит натрия (NaOCl) - порошок с запахом хлора, взрывоопасен в присутствии органических веществ. Его производят в промышленном масштабе и выпускают в виде кристаллов, основных солей и водных растворов. Растворимость в воде при 15° С составляет около 30%, при 20° С - свыше 50%, в горячей воде разлагается.
Монохлорамин ДТ-1 (C6H5SO2NaNCl - натриевая соль N-хлорамида бензолсульфокислоты) - желтоватый кристаллический порошок с запахом хлора, хорошо растворимый в воде.
Дихлорамин ДТ-2 (C6H5SO2NaCl2 - дихлорамид бензолсульфокислоты) - представляет собой бесцветные или желтоватые чешуйчатые пластины с запахом хлора. Они практически нерастворимы в воде, но хорошо растворяются в органических растворителях (бензоле, толуоле, дихлорэтане).
Дихлорэтан (ClCH2 - CH2Cl) - летучая, бесцветная или слегка желтоватая жидкость со специфическим запахом. Температура кипения - 84° С, замерзания - минус 35 ° С.
Едкий натр (NaOH - натрия гидроксид) - представляет собой плавленый монолит или мелкие чешуйки. На воздухе поглощает влагу и углекислый газ.
Аммиачная вода (NH4 OH) - 20-25%-ный раствор аммиака в воде. Температура замерзания зависит от содержания в ней аммиака и составляет для 25%-ного раствора минус 40° С.
Моноэтаноламин (H2NCH2СН2OH) - вязкая маслянистая жидкость, обладающая слабым запахом аммиака; во всех отношениях смешивается с водой; содержит 70% основного вещества. Температура замерзания минус 30° С.
Гидроксиламин (NH2OH) - твердое вещество с температурой плавления 32° С, гигроскопично. Растворяется в воде, спирте; не растворяется в бензоле.
Кислота серная (H2SO4) - бесцветная жидкость. При приготовлении растворов ее всегда приливают к воде, а не наоборот, во избежание разбрызгивания из-за вскипания воды.
Кислота соляная (HCl) - бесцветная жидкость с резким запахом хлороводорода.
Перекись водорода (H2O2) - смешивается с водой в любых соотношениях. 30%-ный водный раствор перекиси водорода, содержащий стабилизирующие добавки, называется пергидролем.
Сульфид натрия - порошок с температурой плавления 1180 °С. Сильно гигроскопичен. При действии воздуха и света окисляется и при этом желтеет. В воде при температуре 20 ° С растворяется около 14%.
Формальдегид (НСОН) - бесцветный газ с резким запахом, хорошо растворим в воде. В практике используется в виде 35-40% - ных растворов в воде под названием "формалин".
Алкилбензолсульфонаты (CnH2n - C6H4 - SO2 - ONa), называемые "сульфонолами". На их основе готовятся препараты моющего действия типа СФ-У. В состав СФ-2У входят: сульфанол (25%), триполифосфат натрия (50%), сульфат натрия (15%), несульфированные вещества, влага (10%). СФ - 2У представляет собой однородный мелкодисперсный порошок желтого цвета, хорошо растворимый в воде любой жесткости.