Lecture
Спектрофотометрия в обратно рассеянном свете. Гемоглобиномеры и сенсоры кровенаполнения
19.3. Неинвазивные гемоглобиномеры
19.3.1. Первый сенсор гемоглобина, работавший "на отражение"
Принцип действия и конструкция первого интеллектуального неинвазивного гемоглобиномера – сенсора, предназначенного для измерения концентрации гемоглобина, были запатентованы в 1994 г. [ [ 273 ] , [ 274 ] ] и описаны в [ [ 179 ] ]. Структура его оптоэлектронной части показана на рис. 19.8.
В середине 90-х годов еще не было достаточно узкополосных сине-зеленых светодиодов, излучающих свет в нужных для гемоглобиномера спектральных интервалах. Поэтому в качестве источника света использовалась миниатюрная импульсная лампа-вспышка (1) высокого давления для фотоаппаратов, располагавшаяся из соображений электробезопасности внутри корпуса прибора. (Для работы лампы требовалось напряжение до 300 В, а сила разрядного тока в коротком миллисекундном импульсе достигала 50 А).

Рис. 19.8. Оптоэлектронная часть неинвазивного гемоглобиномера "ИГН-300": 1 - миниатюрная лампа-вспышка; 2 - вспомогательный светофильтр; 3 - световод зондирующего пучка; 4 - плоскость выхода световодов; 5 - световод опорного пучка; 6 - световод измерительного пучка; 7 - сине-зеленый светофильтр; 8 - фотоприемник измерительного канала; 9 - БИК светофильтр; 10 - фотоприемник опорного канала; 11 - условно показан путь света сквозь исследуемый участок тела
Лампа-вспышка излучает свет непрерывного спектра в диапазоне длин волны приблизительно от 300 до 1300 нм. Коротковолновая часть спектра (до 450 нм) сразу отсекалась вспомогательным светофильтром (2). Остальной свет с помощью пучка оптических волокон (3) направлялся к исследуемому участку тела человека. Из обратно рассеянного телом света с помощью волоконно-оптических световодов (5) и (6) отбирались симметрично расположенные пучки, выходящие из тела на расстоянии 1,5 мм от места входа зондирующего светового пучка перпендикулярно поверхности тела. Для этого волоконно-оптические световоды 3, 5 и 6 были выведены торцами в общую плоскость (4). Расстояние между ними было конструктивно фиксировано, плоскость 4 сошлифована и оптически отполирована. Отобранные для измерений пучки обратно рассеянного телом света через волоконно-оптические световоды 5 и 6 направлялись к опорному и измерительному каналам. В измерительном канале перед фотоприемником (8) был установлен узкополосный интерференционный светофильтр (7), который пропускал на фотоприемник только излучение узкого спектрального интервала из сине-зелёной области спектра. В опорном канале перед фотоприемником (10) был установлен узкополосный интерференционный светофильтр (9), который пропускал на фотоприемник только излучение узкого спектрального интервала из ближней инфракрасной области спектра.
При измерениях т.н. "общего ( total ) гемоглобина крови" результат измерения не должен зависеть от насыщенности крови кислородом. Поэтому длина волны света \[ \lambda_{\text{И}} \] , пропускаемого светофильтром 7 в измерительном канале была выбрана так, чтобы коэффициенты поглощения двух главных форм гемоглобина совпадали. Изучение показало, что для этого пригодны такие спектральные интервалы: (506,5 \[ \pm \] 7) нм, (523 \[ \pm \] 7) нм, (549 \[ \pm \] 7) нм, (569 \[ \pm \] 7) нм, (586 \[ \pm \] 7) нм. Опорная длина волны \[ \lambda_O \] была выбрана между 830 и 960 нм, где все формы гемоглобина, как и другие компоненты крови и живой ткани, поглощают свет относительно слабо. Рассеяние и фоновое поглощение света на обеих указанных длинах волны приблизительно одинаковы.
Для фильтрации полезных сигналов от помех, кроме оптических интерференционных светофильтров, использован тот факт, что излучение света лампой-вспышкой длится лишь несколько миллисекунд. Усиленные сигналы от фотоприемников с помощью операционных усилителей интегрировались на конденсаторах. Интегрирование в обоих каналах прекращалось, когда напряжение на конденсаторе в опорном канале достигало заданного порога. Поэтому светосумма, набранная в опорном канале, всегда была одинакова. Если пропускание кожи было меньше обычного, например, из-за пигментации или загара, то интегрирование продолжалось дольше, а в случае более прозрачной кожи время интегрирования автоматически сокращалось. Тем самым компенсировалось и влияние флуктуаций интенсивности излучения лампы-вспышки. Благодаря интегрированию в течение порядка 1 мс, автоматически отфильтровывались шумы и помехи с частотами выше 3 кГц.
Воспроизводимость результатов измерений на одном и том же участке тела одного и того же человека иллюстрирует рис. 19.9, где показаны результаты 60 проведенных подряд измерений. По горизонтали отложены измеренные значения, по вертикали – количество полученных результатов из выделенного диапазона значений (от 130 до 132, от 132 до 134 и т.д.). Приблизительно гауссовское распределение свидетельствует о случайном характере разброса результатов.

Рис. 19.9. Гистограмма результатов неинвазивных измерений концентрации гемоглобина сенсором ИГН-300 на руке человека
Дисперсия отклонений не превышала 5-7 % от среднего значения. Сенсор хорошо отслеживал изменения концентрации гемоглобина в ткани, вызванные различными факторами: приливами и оттоками крови, повышением (понижением) артериального давления, уменьшением (повышением) концентрации гемоглобина в крови, вызванным, например, кровотечением или внутривенным вливанием крови, и т.д.
19.3.2. Принцип измерения концентрации гемоглобина
Спектральные интенсивности света, отбираемого оптическими волокнами для измерений на выходе из тела, описываются уравнениями: \[ I_O=T_OI_{O,0} \exp\lfloor-(K_{P,O}+K_{\textit{Ф},O}+k_{Hb,O}c_{Hb})d\rfloor, \] \[ I_{\textit{И}}=T_{\textit{И}}I_{\textit{И},0} \exp\lfloor-(K_{P,\textit{И}}+K_{\textit{Ф,И}}+k_{Hb,\textit{И}}c_{Hb})d\rfloor, \] где индексы " О " и " И " указывают на опорную и измерительную длину волны \[ \lambda_O, \lambda_{\textit{И}} \] соответственно;
\[ I_{O,0}, I_{\textit{И},0} \] – спектральные интенсивности света на входе в тело;
\[ T_O, T_{\textit{И}} \] – безразмерные коэффициенты, учитывающие пропускание света кожей, эффективность отбора и передачи оптических сигналов к фотоприемнику, пропускание светофильтров и спектральную чувствительность фотоприемников в опорном и измерительном каналах;
\[ K_{P,O}, K_{P,\textit{И}} \] – коэффициенты рассеяния света тканью на исследуемом участке тела, задаются в мм-1;
\[ K_{\textit{Ф},O, K_{\textit{Ф,И} \] – коэффициенты фонового поглощения света, т.е. всеми другими компонентами ткани, кроме гемоглобина, также в мм-1;
\[ k_{Hb,O}, k_{Hb,\textit{И}} \] – молярные коэффициенты поглощения света гемоглобином ( \[ Hb \] ), задаются л/(моль*мм);
\[ c_{Hb} \] – молярная концентрация гемоглобина, моль/л;
\[ d \] – средняя длина пути, который проходит в ткани свет, выделяемый и принимаемый оптическими волокнами (мм).
Если выражение (19.5) поделить на выражение (19.6) и учесть то, что при длинах волны \[ \lambda_O \] и \[ \lambda_\textit{И} \] рассеяние и фоновое поглощение света практически одинаковы (т.е. \[ K_{P,O} \approx K_{P,\textit{И}} \] и \[ K_{\textit{Ф},O \approx K_{\textit{Ф,И}} \] ), а молярные коэффициенты поглощения гемоглобином отличаются сильно \[ (k_{Hb,\textit{И}} >> k_{Hb,О}) \] , то получим: \[ I_O/I_{\textit{И}}=(T_OI_{O,0})/(T_{\textit{И}}I_{\textit{И},0}) \exp\lfloor(k_{Hb,\textit{И}}-k_{Hb,0})c_{Hb}d\rfloor. \]
Это выражение можно рассматривать как уравнение для нахождения концентрации гемоглобина \[ c_{Hb} \] . Решив его, находим \[ c_{Hb}=\lfloor\ln(I_O/I_{\textit{И}})-\ln(T_OI_{O,0}) + \ln(T_{\textit{И}}I_{\textit{И},0})\rfloor / \lfloor(k_{Hb,\textit{И}}-k_{Hb,O})d\rfloor. \]
Величины \[ T_O, T_{\textit{И}}, I_{O,0}, I_{\textit{И},0} \] и \[ d \] – это константы прибора и определяются его конструкцией, а величины \[ k_{Hb,О} \] и \[ k_{Hb,\textit{И}} \] – оптические константы гемоглобина. Поэтому выражение для вычисления концентрации гемоглобина можно представить в виде \[ c_{Hb}=a\ln(I_O/I_{\textit{И}})-b \] где \[ a \] и \[ b \] – константы, которые можно определить при калибровке прибора.
19.3.3. Современный вариант сенсора гемоглобина
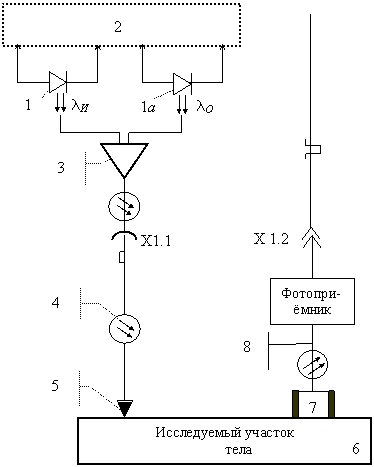
Когда на рынке появились лазерные светодиоды, излучающие свет нужных длин волн, оказалось возможным существенно упростить конструкцию и улучшить технические характеристики сенсора гемоглобина. Новая принципиальная оптическая схема показана на рис. 19.10.
Здесь используются лазерные диоды 1 и 1а, один из которых излучает свет с требуемой длиной волны \[ \lambda_{\textit{И}} \] , а второй – свет с длиной волны \[ \lambda_O \] . Электронная схема управления излучением лазерных диодов 2 включает их поочередно. С помощью оптического концентратора и смесителя 3 свет от обоих лазерных диодов направляется через оптический соединитель Х1.1 в гибкий волоконно-оптический кабель 4. Этот кабель электрически и оптически соединяет основной корпус прибора с легкой выносной оптоэлектронной головкой. Внутри этой головки свет по оптическому волокну подается к центру 5 выхода головки, который приводится в оптический контакт с исследуемым участком тела 6. Из волокна остросфокусированный пучок света ("световой зонд") входит сквозь кожу в живую ткань. Часть прошедшего сквозь ткань и обратно рассеянного света выходит наружу. Оптический узел 7 выделяет из этого света нужную составляющую. По оптическому волокну 8 выделенная составляющая направляется на фотоприемник. В те интервалы времени, когда излучает лазерный диод 1, фотоприемник формирует электрический сигнал, пропорциональный спектральной интенсивности \[ І_{\textit{И}} \] , а когда излучает лазерный диод 1а, то формируется сигнал, пропорциональный спектральной интенсивности І_O.
При применении лазерных диодов удается ввести в оптическое волокно почти весь излучаемый ими световой поток, при использовании обычных светодиодов – до 30% светового потока. Ранее же, при использовании миниатюрной лампы-вспышки, удавалось ввести лишь 5-10% излучаемого светового потока. Это существенно улучшило использование оптических сигналов и позволило существенно сэкономить энергию питающих аккумуляторных батарей.
Конструкция выносной оптоэлектронной головки показана на рис. 19.11.
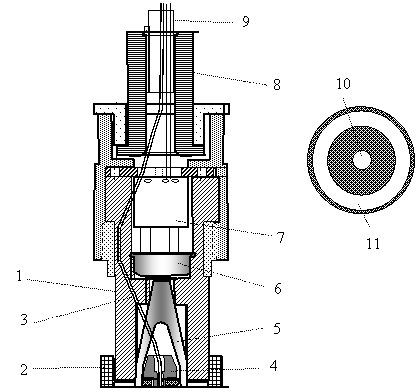
Рис. 19.11. Конструкция выносной оптоэлектронной головки сенсора гемоглобина: 1 – корпус головки; 2 – насадка-диафрагма; 3 – оптическое волокно; 4 – фиксатор облучателя; 5 – конусообразный оптический фокон; 6 – фотоприемник; 7 – предварительный усилитель фототока; 8 – фиксатор соединительного кабеля; 9 – кабель
Головка приводится в оптический контакт с исследуемым участком тела со стороны насадки 2, которая одновременно является и диафрагмой для ограничения не используемой части обратно рассеянного телом света. Конусообразный оптический фокон 5 является внутри полым, имеет форму воронки. Внутри его полости расположен фиксатор облучателя 4, позволяющий точно центрировать выход оптического волокна. Оптическое волокно 3 входит в эту полость сквозь небольшое отверстие в стенке фокона. Собираемый фоконом 5 обратно рассеянный свет поступает на фотоприемник 6. Получаемый электрический сигнал, пропорциональный интенсивности собранного света, усиливается в миниатюрном предварительном усилителе сигналов 7, тоже размещенном внутри головки.
Фиксатор 8 механически крепит соединительный кабель и препятствует проникновению внутрь головки постороннего света. Геометрия торца насадки-дифрагмы 2, которая приводится в оптический контакт с телом, показана на рис. 19.11 справа. Прозрачный круг 10 в центре – это торец входного оптического волокна 3, имеющий диаметр 1 мм. Через него зондирующий пучок света вводится в ткань. Прозрачное кольцо 11, концентрическое с кругом 10, – это торец конусообразного оптического фокона, через который отбирается для измерения только та часть обратно рассеянного телом света, которая выходит на заданном расстоянии от точки входа светового зонда. Условия внутреннего отражения в фоконе таковы, что к фотоприемнику 6 доходят только составляющие обратно рассеянного света, выходящие перпендикулярно к поверхности тела \[ \pm \] 10-20 \[ \deg \] .
Таким образом, конструкция выносной оптоэлектронной головки обеспечивает выполнение всех сформулированных в п. 19.2.4 требований технологии измерений в обратно рассеянном свете. Применение описанного фокона, размещение в головке также фотоприемника и предварительного усилителя фототока на порядок повысило эффективность использования светового сигнала. По соединительному кабелю передается теперь значительно усиленный электрический сигнал с низким выходным омическим сопротивлением, что резко уменьшает влияние шумов. Благодаря узкополосности излучения лазерных диодов стали не нужны сложные и дорогие интерференционные светофильтры. Используется только один фотоприемник и тракт усиления. Для питания источников света не требуется высокое напряжение, что повышает электробезопасность прибора.
Общий вид современного варианта сенсора гемоглобина показан на рис. 19.12.

Рис. 19.12. Общий вид портативного сенсора гемоглобина: 1 – корпус сенсора; 2 – выносная оптоэлектронная головка; 3 – соединительный кабель
Размеры основного блока сенсора – 145x52x40 мм, масса – 0,3 кг. Масса выносной оптоэлектронной головки – до 40 г. Длина соединительного кабеля 0,5 м или 1 м. При измерениях торец головки приводится в оптический контакт с исследуемым участком тела. Головка не должна оказывать никакого существенного давления на тело, чтобы не менять его кровенаполнение. После нажатия кнопки "Пуск" встроенный микроконтроллер организует весь процесс измерения: включение источников света, модуляцию их светового потока, прием и усиление сигналов, поступающих от головки, их демодуляцию, разделение, измерение спектральных интенсивностей, расчет концентрации гемоглобина. Имеется функция автоматического регулирования интенсивности зондирующего пучка света (порядка 0,1 мВт) в зависимости от оптических свойств кожи. Результаты измерения выводятся на жидкокристаллический дисплей, запоминаются в долговременной памяти, откуда могут быть переданы во внешний компьютер. Энергоёмкости встроенного аккумулятора хватает на проведение до 20 тыс. измерений.